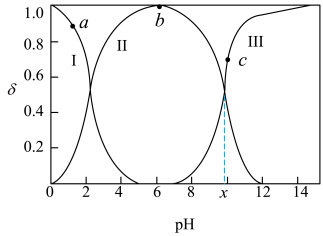
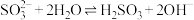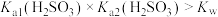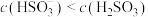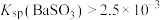室温下,甘氨酸在水溶液中主要以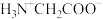 、
、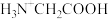 和
和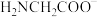 的形式存在,在甘氨酸水溶液中加入
的形式存在,在甘氨酸水溶液中加入 或盐酸调节
或盐酸调节 ,实验测得甘氨酸溶液中各微粒分布分数
,实验测得甘氨酸溶液中各微粒分布分数 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
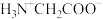 、
、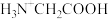 和
和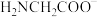 的形式存在,在甘氨酸水溶液中加入
的形式存在,在甘氨酸水溶液中加入 或盐酸调节
或盐酸调节 ,实验测得甘氨酸溶液中各微粒分布分数
,实验测得甘氨酸溶液中各微粒分布分数 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.a点对应溶液中,水的电离程度大于b点 |
B.c点对应溶液中,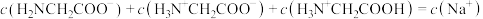 |
C.甘氨酸电离出 的平衡常数 的平衡常数 为 为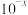 |
D. 点溶液中,存在关系式: 点溶液中,存在关系式: |
2023高三·全国·专题练习 查看更多[1]
(已下线)易错点9混淆三个守恒而错判微粒浓度关系
更新时间:2023-02-13 08:43:43
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向20mL0.1 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
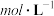 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
A.常温下,0.1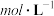 氨水中 氨水中 的电离常数K约为 的电离常数K约为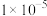 |
B.a、b之间的点一定满足,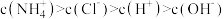 |
C.c点溶液中 |
| D.d点代表两溶液恰好完全反应 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是
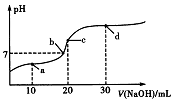
| A.HR为强电解质 |
| B.图中四点,水的电离程度:c>b>d>a |
| C.若常温时0.1mol/LHR溶液的电离度为1%,则常温时R-的水解常数约为10-9 |
| D.b点溶液中存在c(Na+)=c(R-)+c(HR) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时H2A的Ka1=4.3×10-7,Ka2=5.6×10-11,HB的Ka=3×10-8。下列说法正确的是
| A.加水稀释H2A溶液,水电离出的c(H+)•c(OH-)保持不变 |
| B.相同物质的量浓度的NaHA溶液和NaB溶液等体积混合后,溶液中c(HA-)<c(B-) |
| C.Na2A溶液中加H2A至中性,溶液中c(HA-)>c(H2A)>c(A2-) |
| D.将两份相同体积和物质的量浓度的NaOH溶液分别加到1L0.1mol·L-1H2A溶液和1L0.2mol·L-1HB溶液中,前者pH一定更小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】室温下,通过下列实验探究有关 的性质[已知:
的性质[已知: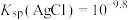 ]。
]。
实验1:向
 的
的 溶液中滴加
溶液中滴加
 的NaCl溶液,产生白色沉淀,过滤,
的NaCl溶液,产生白色沉淀,过滤,
实验2:向实验1所得滤液中滴加

 溶液,产生淡黄色沉淀,过滤。
溶液,产生淡黄色沉淀,过滤。
实验3:向实验2所得滤液中逐滴滴加氨水,产生沉淀先变多后变少,直至消失。
下列说法正确的是
 的性质[已知:
的性质[已知: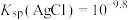 ]。
]。实验1:向

 的
的 溶液中滴加
溶液中滴加
 的NaCl溶液,产生白色沉淀,过滤,
的NaCl溶液,产生白色沉淀,过滤,实验2:向实验1所得滤液中滴加


 溶液,产生淡黄色沉淀,过滤。
溶液,产生淡黄色沉淀,过滤。实验3:向实验2所得滤液中逐滴滴加氨水,产生沉淀先变多后变少,直至消失。
下列说法正确的是
A.实验1过滤后滤液中 |
B.通过实验1和实验2可得出 |
C.实验2所得滤液中 |
D.实验3滴加氨水过程中,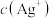 一直减小 一直减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】已知Na2CO3与稀盐酸反应分两步进行: +H+==
+H+== ,
, +H+= CO2↑+H2O。向10.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液pH随盐酸体积的变化如图。
+H+= CO2↑+H2O。向10.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液pH随盐酸体积的变化如图。
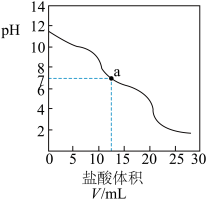
下列说法不正确的是
A.V = 5.00mL时,溶液中c( )>c( )>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
B.V =10.00mL时,溶液中c(Na+)=c( )+c( )+c( )+c(H2CO3)+c(Cl-) )+c(H2CO3)+c(Cl-) |
C.a点的溶液中:n( )+n( )+n( ) = 0.001 mol ) = 0.001 mol |
D.V = 20.00mL时,溶液pH<7,是因为H2CO3   + H+ + H+ |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
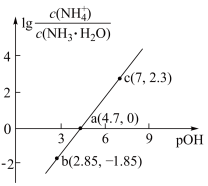
【推荐1】已知:pOH=-lgc(OH-)。室温下,向浓度为0.1mol·L-1的氨水中缓缓通入HCl,lg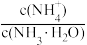 随pOH的变化曲线如图所示。假设溶液体积没有变化,下列推断错误的是
随pOH的变化曲线如图所示。假设溶液体积没有变化,下列推断错误的是
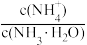 随pOH的变化曲线如图所示。假设溶液体积没有变化,下列推断错误的是
随pOH的变化曲线如图所示。假设溶液体积没有变化,下列推断错误的是
| A.室温下,NH3·H2O的电离常数为10-4.7 |
B.b点溶液中:c(NH3·H2O)>c( ) ) |
| C.pOH=8的溶液中:c(NH3·H2O)+c(Cl-)>0.1mol·L-1 |
| D.c点溶液中:c(Cl-)=0.1mol·L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】25℃时,用HCl气体调节 氨水的pH,溶液中微粒浓度的对数值
氨水的pH,溶液中微粒浓度的对数值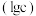 、反应物的物质的量之比
、反应物的物质的量之比 与pH的关系如下图,若忽略通入气体后溶液体积的变化,下列说法正确的是
与pH的关系如下图,若忽略通入气体后溶液体积的变化,下列说法正确的是
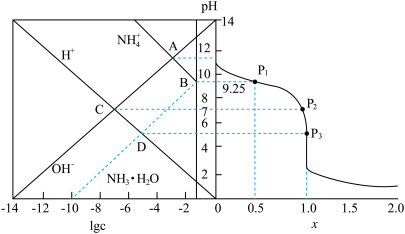
 氨水的pH,溶液中微粒浓度的对数值
氨水的pH,溶液中微粒浓度的对数值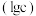 、反应物的物质的量之比
、反应物的物质的量之比 与pH的关系如下图,若忽略通入气体后溶液体积的变化,下列说法正确的是
与pH的关系如下图,若忽略通入气体后溶液体积的变化,下列说法正确的是
| A.25℃时,图中各点对应的溶液中水的电离程度:A>B>C>D |
B. 所示溶液中 所示溶液中 是 是 所示溶液中 所示溶液中 的2倍 的2倍 |
C.C所示溶液中: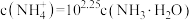 |
D.25℃时,若改用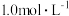 氨水, 氨水, 时, 时, 会上移 会上移 |
您最近一年使用:0次

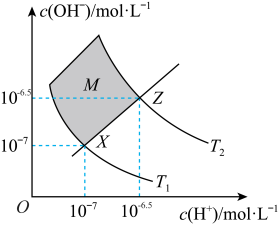
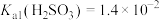 ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质:
溶液的性质:
 ,再滴入2滴紫色石蕊试剂,溶液呈红色。
,再滴入2滴紫色石蕊试剂,溶液呈红色。 溶液,产生白色沉淀。
溶液,产生白色沉淀。