已知25℃时部分弱酸的电离平衡常数如下表:
则下列说法正确的是
| 弱酸 |  |  | HClO |
| 电离平衡常数 |  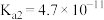 | 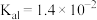 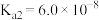 |  |
A.向NaClO溶液中通入少量 发生反应: 发生反应: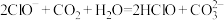 |
B.向NaClO溶液中通入少量 发生反应: 发生反应: |
C.室温下,同浓度 、 、 、NaClO溶液的pH关系: 、NaClO溶液的pH关系: |
D.相同物质的量浓度的溶液中,由水电离出的 : : |
22-23高三下·湖南·阶段练习 查看更多[3]
更新时间:2023-03-17 22:06:19
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】若NA是阿伏加德罗常数的值,下列说法正确的是
| A.0.1 L 1 mol/L AlCl3溶液中,Al3+数目为0.1NA |
| B.1 L pH=1的醋酸溶液中,H+数目为0.1NA |
| C.1 L 0.1 mol/L的氨水溶液中,OH-数目为0.1NA |
| D.1 mol N2与足量H2反应,生成NH3数目为2NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列事实能说明醋酸是弱电解质的是
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
| A.①③ | B.①④ | C.②③ | D.③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】已知:下表为25℃时某些弱酸的电离平衡常数。
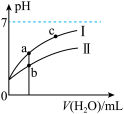
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7;Ka2=4.7×10-11 |

如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
| A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+ |
| C.图像中a点的酸的总浓度大于b点酸的总浓度 |
D.图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO) 相等(HR代表CH3COOH或HClO) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A. 溶液中所含 溶液中所含 的数目为 的数目为 |
B.常温下, 的 的 溶液中 溶液中 的数目约为 的数目约为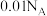 |
C.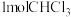 含有σ键的数目为 含有σ键的数目为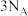 |
D.密闭容器中, 和 和 催化反应后分子总数为 催化反应后分子总数为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】物质的量浓度相同的下列溶液,pH由大到小排列正确的是
| A.Ba(OH)2、Na2SO3、FeCl3、KCl |
| B.Na2SiO3、Na2CO3、KNO3、NH4Cl |
| C.NH3·H2O、H3PO4、Na2SO4、H2SO4 |
| D.NaHCO3、C6H5COOH、C2H5OH、HCl |
您最近一年使用:0次
【推荐3】下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究葡萄糖的还原性 | 在一支试管中先加入2mL10%NaOH溶液,滴入5滴 溶液,再加入2mL10%葡萄糖溶液,加热,观察实验现象 溶液,再加入2mL10%葡萄糖溶液,加热,观察实验现象 |
B | 探究过氧化氢能否将亚硫酸盐氧化 | 向过氧化氢和氯化钡混合液中滴加亚硫酸钠溶液,观察是否产生白色沉淀 |
C | 验证草酸为二元弱酸 | 用0.1mol/LNaOH标准溶液滴定等浓度草酸溶液,使用酚酞作指示剂,到达滴定终点时消耗NaOH的体积为草酸的2倍 |
D | 探究水解程度: | 用pH计分别测定饱和 和 和 溶液的pH,前者pH大 溶液的pH,前者pH大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



