赤泥硫酸铵焙烧浸出液水解制备偏钛酸[TiO(OH)2]可回收钛。
已知:
i.⼀定条件下,Ti4+水解⽅程式:
ii.⼀定温度下: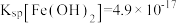 ;
;
I.赤泥与硫酸铵混合制取浸出液。
(1)用化学用语表示(NH4)2SO4溶液呈酸性的原因___________ 。
II.水解制备偏钛酸:浸出液中含Fe3+、Ti4+等,先向其中加入还原铁粉,然后控制水解条件实现Ti4+水解制备偏钛酸。
(2)浸出液(pH=2)中含有大量Ti4+,若杂质离子沉淀会降低钛水解率。从定量⻆度解释加入还原铁粉的目的___________ 。
(3)⼀定条件下,还原铁粉添加比对钛水解率的影响如图所示。当还原铁粉添加比大于1时,钛水解率急剧下降,解释其原因___________ 。 ;n铁粉为还原铁粉添加量,n理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量。
;n铁粉为还原铁粉添加量,n理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量。
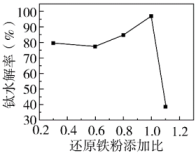
(4)⼀定条件下,温度对钛水解率的影响如图所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因___________ 。___________ (填“正”或“负”)极。
(6)写出电极Y上发生的电极反应式___________ 。
已知:
i.⼀定条件下,Ti4+水解⽅程式:

ii.⼀定温度下:
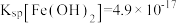 ;
;
I.赤泥与硫酸铵混合制取浸出液。
(1)用化学用语表示(NH4)2SO4溶液呈酸性的原因
II.水解制备偏钛酸:浸出液中含Fe3+、Ti4+等,先向其中加入还原铁粉,然后控制水解条件实现Ti4+水解制备偏钛酸。
(2)浸出液(pH=2)中含有大量Ti4+,若杂质离子沉淀会降低钛水解率。从定量⻆度解释加入还原铁粉的目的
(3)⼀定条件下,还原铁粉添加比对钛水解率的影响如图所示。当还原铁粉添加比大于1时,钛水解率急剧下降,解释其原因
 ;n铁粉为还原铁粉添加量,n理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量。
;n铁粉为还原铁粉添加量,n理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量。(4)⼀定条件下,温度对钛水解率的影响如图所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因
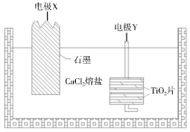
(6)写出电极Y上发生的电极反应式
2023·北京丰台·一模 查看更多[3]
更新时间:2023-03-24 13:16:38
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的 可转化为
可转化为 ,该反应分两步反应:
,该反应分两步反应:
Ⅰ:
Ⅱ: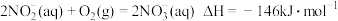
则低浓度氨氮废水中的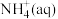 氧化生成
氧化生成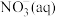 的热化学方程式为
的热化学方程式为________________ 。
(2)在容积固定的密闭容器中,通入一定量的 ,发生反应
,发生反应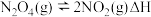 ,随温度升高,混合气体的颜色变深。
,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为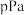 ,
, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
______________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高, 值将
值将___________ (填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________ (填“正反应”或“逆反应”)方向移动,判断理由是__________________________ 。
(1)微生物作用下,废水中的
 可转化为
可转化为 ,该反应分两步反应:
,该反应分两步反应:Ⅰ:

Ⅱ:
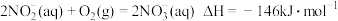
则低浓度氨氮废水中的
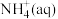 氧化生成
氧化生成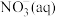 的热化学方程式为
的热化学方程式为(2)在容积固定的密闭容器中,通入一定量的
 ,发生反应
,发生反应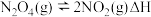 ,随温度升高,混合气体的颜色变深。
,随温度升高,混合气体的颜色变深。①温度T时反应达平衡,混合气体平衡总压强为
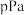 ,
, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
 值将
值将②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)

(1)计算在20至40秒时间内,NO2的平均生成速率为_______________ 。
(2)该反应的化学平衡常数表达式为______________ 。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
据此可推测该反应(生成NO2)是________ 反应(选填“吸热”或“放热”)。
(4)反应达平衡后再加入0.100mol无色的N2O4气体,推测反应重新达到平衡后N2O4的转化率___________ (增大、不变、减小).
 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为
(2)该反应的化学平衡常数表达式为
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
| T/ K | 323 | 373 |
| K值 | 0.022 | 0.36 |
据此可推测该反应(生成NO2)是
(4)反应达平衡后再加入0.100mol无色的N2O4气体,推测反应重新达到平衡后N2O4的转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】碳、硫、氮及其化合物在工农业、国防等领域占有重要地位。
(1)已知:
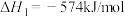


若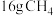 和
和 充分反应,生成
充分反应,生成 、
、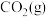 和
和 ,共放出热量867kJ,则
,共放出热量867kJ,则
_____ 。
(2) 与
与 之间存在反应
之间存在反应 。在一定条件下,该反应
。在一定条件下,该反应 、
、 的消耗速率与自身压强间存在关系
的消耗速率与自身压强间存在关系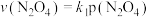 ,
,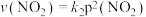 ,其中
,其中 、
、 是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,
是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是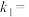
_____ ,在下图上标出的点中,能表示反应达到平衡状态的点为_____ (填字母代号)。
(3)在有氧条件下,新型催化剂M能催化 与
与 反应生成
反应生成 。
。
① 与
与 生成
生成 的反应中,当生成
的反应中,当生成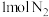 时,转移的电子为
时,转移的电子为_____  。
。
②将一定比例的 、
、 和
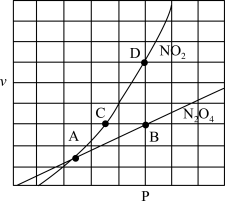
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间 的去除率随反应温度的变化曲线(如图2)所示,在
的去除率随反应温度的变化曲线(如图2)所示,在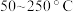 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是_____ ;当反应温度高于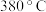 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是_____ 。
(1)已知:

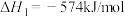


若
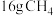 和
和 充分反应,生成
充分反应,生成 、
、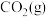 和
和 ,共放出热量867kJ,则
,共放出热量867kJ,则
(2)
 与
与 之间存在反应
之间存在反应 。在一定条件下,该反应
。在一定条件下,该反应 、
、 的消耗速率与自身压强间存在关系
的消耗速率与自身压强间存在关系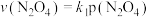 ,
,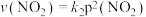 ,其中
,其中 、
、 是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,
是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是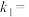

(3)在有氧条件下,新型催化剂M能催化
 与
与 反应生成
反应生成 。
。
①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成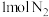 时,转移的电子为
时,转移的电子为 。
。②将一定比例的
 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间 的去除率随反应温度的变化曲线(如图2)所示,在
的去除率随反应温度的变化曲线(如图2)所示,在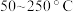 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是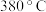 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。纳米级Fe3O4有多种不同制法,请回答下列相关问题。
I.下图是用共沉淀法制备纳米四氧化三铁的流程。
(1)除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是___ (填化学式),该物质的用途是___ (任写一种)。
(2)实验室保存溶液B 时为了防止出现浑浊通常采用的措施是___ 。
(3)证明沉淀已经洗涤干净的操作是_________ 。
(4)写出该方法中发生的主要反应的离子方程式___________ 。
(5)实际生产中为提高产率,起始所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1:2,原因是______ 。
II.制备纳米四氧化三铁的另一种流程如下图所示。

(6)写出第2 步反应的化学方程式______________ ,其中氧化产物和还原产物的物质的量之比为______ 。
(7)纳米Fe3O4投入分散剂中形成的分散系是______________ 。
I.下图是用共沉淀法制备纳米四氧化三铁的流程。
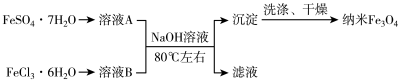
(1)除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是
(2)实验室保存溶液B 时为了防止出现浑浊通常采用的措施是
(3)证明沉淀已经洗涤干净的操作是
(4)写出该方法中发生的主要反应的离子方程式
(5)实际生产中为提高产率,起始所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1:2,原因是
II.制备纳米四氧化三铁的另一种流程如下图所示。

(6)写出第2 步反应的化学方程式
(7)纳米Fe3O4投入分散剂中形成的分散系是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】硼在冶金、核工业、农业、高新材料等方面都有重要的应用,一种利用硼镁矿制取粗硼的工艺流程:
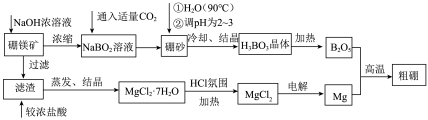
已知:硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7)·10H2O。
回答下列问题:
(1)硼镁矿要粉碎处理,其目的是_______ ,NaOH浓溶液与硼镁矿反应的化学方程式为__________________________________ (不考虑杂质参与反应)。
(2)实验室过滤操作中要用到的玻璃仪器包括烧杯、_______ 、______ 。洗涤沉淀的操作方法为_____________________________________ 。
(3)试解释流程中生成无水MgCl2需在HCl氛围中进行的原因:___________________ 。
(4)已知H3BO3为一元弱酸,其与NaOH反应的化学方程式为NaOH+H3BO3=Na[B(OH)4],写出H3BO3的电离方程式:_________________________________________ 。
(5)实验测得一定质量的H3BO3在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。
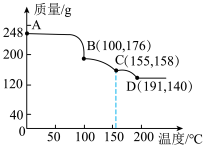
①C对应的物质可表示为2B2O3·nH2O,则n=_______
②写出C到D过程中发生反应的化学方程式:______________ 。

已知:硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7)·10H2O。
回答下列问题:
(1)硼镁矿要粉碎处理,其目的是
(2)实验室过滤操作中要用到的玻璃仪器包括烧杯、
(3)试解释流程中生成无水MgCl2需在HCl氛围中进行的原因:
(4)已知H3BO3为一元弱酸,其与NaOH反应的化学方程式为NaOH+H3BO3=Na[B(OH)4],写出H3BO3的电离方程式:
(5)实验测得一定质量的H3BO3在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。

①C对应的物质可表示为2B2O3·nH2O,则n=
②写出C到D过程中发生反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以炼锌厂的烟道灰(主要成分为ZnO,还含有少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O),其工艺流程如图所示:
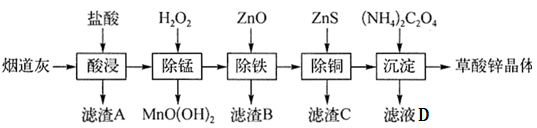
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)酸浸后产生的金属阳离子主要有Zn2+,还有少量______ ;滤渣A的主要成分为______ (填化学式)。
(2)盐酸酸浸过程中,为了提高浸取效率,可采取的措施有______ (写出两条即可)。
(3)“除锰”过程中加入H2O2的作用为______ (用离子方程式表示)。
(4)“调pH”控制溶液的pH范围为3.3≤pH<5.4,滤渣B的成分有______ (填化学式)。
(5)生成滤渣C的离子方程式为______ 。
(6)滤液D和草酸锌晶体分离的操作为______ (写操作名称)。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 6.7 | 8.2 |
(2)盐酸酸浸过程中,为了提高浸取效率,可采取的措施有
(3)“除锰”过程中加入H2O2的作用为
(4)“调pH”控制溶液的pH范围为3.3≤pH<5.4,滤渣B的成分有
(5)生成滤渣C的离子方程式为
(6)滤液D和草酸锌晶体分离的操作为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】钼酸钠晶体( )可用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(主要成分为
)可用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(主要成分为 ,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。

请回答下列问题:
(1) 中Mo的化合价为
中Mo的化合价为___________
(2)“焙烧”时,有 生成,反应的化学方程式为
生成,反应的化学方程式为___________ ,氧化产物是___________
(3)“碱浸”生成 和另外一种物质,
和另外一种物质, 的电子式为
的电子式为___________ ,另外一种生成物的化学式为___________
(4)若“除重金属离子”时加入的沉淀剂为 ,则废渣的成分为
,则废渣的成分为___________  填化学式
填化学式
(5)测得“除重金属离子”中部分离子的浓度: “结晶”前应先除去
“结晶”前应先除去 ,方法是加入
,方法是加入 固体。假设加入
固体。假设加入 固体后溶液体积不变,当
固体后溶液体积不变,当 开始沉淀时,去除的
开始沉淀时,去除的 的质量分数为
的质量分数为___________  已知
已知
 )可用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(主要成分为
)可用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(主要成分为 ,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
请回答下列问题:
(1)
 中Mo的化合价为
中Mo的化合价为(2)“焙烧”时,有
 生成,反应的化学方程式为
生成,反应的化学方程式为(3)“碱浸”生成
 和另外一种物质,
和另外一种物质, 的电子式为
的电子式为(4)若“除重金属离子”时加入的沉淀剂为
 ,则废渣的成分为
,则废渣的成分为 填化学式
填化学式
(5)测得“除重金属离子”中部分离子的浓度:
 “结晶”前应先除去
“结晶”前应先除去 ,方法是加入
,方法是加入 固体。假设加入
固体。假设加入 固体后溶液体积不变,当
固体后溶液体积不变,当 开始沉淀时,去除的
开始沉淀时,去除的 的质量分数为
的质量分数为 已知
已知
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】皓矾( )在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS.含有少量
)在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS.含有少量 ,FeO,CuS,NiS,
,FeO,CuS,NiS, 等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
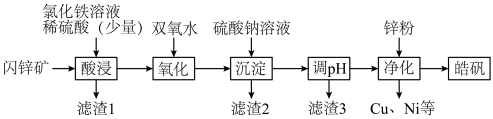
回答下列问题:
(1)基态锌原子价层电子排布式为______ ;S、O、Si三种元素中,第一电离能最大的是______ 。
(2)“酸浸”时,ZnS和 反应的离子方程式为
反应的离子方程式为____________ 。
(3)“氧化”时,双氧水实际消耗量远大于理论计算值,除温度因素外,可能的原因是____________ 。
(4)“滤渣2”为黄钠铁矾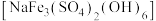 沉淀,产生该沉淀的离子方程式为
沉淀,产生该沉淀的离子方程式为____________ 。
(5)“净化”时,若将除去 和
和 的反应设计成原电池,正极生成的物质是
的反应设计成原电池,正极生成的物质是______ (填化学式)。
(6)该工艺产生的废液中含有 ,需要先处理后排放。向废液中加入由
,需要先处理后排放。向废液中加入由 和
和 组成的缓冲溶液调节pH,再通入
组成的缓冲溶液调节pH,再通入 发生反应:
发生反应: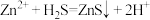 .处理后的废液中部分微粒浓度如下:
.处理后的废液中部分微粒浓度如下:
则
______ ,该废水______ (填“能”或“不能”)排放。
已知:常温下, ,
, ,
, ,
,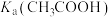
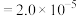 。当
。当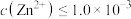 mol⋅L
mol⋅L 时认为废水可以排放。
时认为废水可以排放。
 )在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS.含有少量
)在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS.含有少量 ,FeO,CuS,NiS,
,FeO,CuS,NiS, 等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
回答下列问题:
(1)基态锌原子价层电子排布式为
(2)“酸浸”时,ZnS和
 反应的离子方程式为
反应的离子方程式为(3)“氧化”时,双氧水实际消耗量远大于理论计算值,除温度因素外,可能的原因是
(4)“滤渣2”为黄钠铁矾
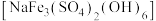 沉淀,产生该沉淀的离子方程式为
沉淀,产生该沉淀的离子方程式为(5)“净化”时,若将除去
 和
和 的反应设计成原电池,正极生成的物质是
的反应设计成原电池,正极生成的物质是(6)该工艺产生的废液中含有
 ,需要先处理后排放。向废液中加入由
,需要先处理后排放。向废液中加入由 和
和 组成的缓冲溶液调节pH,再通入
组成的缓冲溶液调节pH,再通入 发生反应:
发生反应: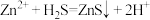 .处理后的废液中部分微粒浓度如下:
.处理后的废液中部分微粒浓度如下:微粒 |
|
|
|
|
浓度/(mol·L | 0.2 | 0.1 | 0.2 | a |

已知:常温下,
 ,
, ,
, ,
,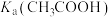
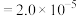 。当
。当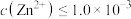 mol⋅L
mol⋅L 时认为废水可以排放。
时认为废水可以排放。
您最近一年使用:0次
【推荐3】工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4 (草酸镍),再经过高温煅烧NiC2O4制取Ni2O3的流程如图所示:

已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法_______ (写一种即可)。
(2)加入H2O2发生的主要反应的离子方程式为_______ 。
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为_______ 。
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25°C时Ksp(CaF2)= 1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5mol·L-1],则“除钙”时需控制混合溶液中F的浓度至少为_______ mol·L-1。
(5)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为_______ 。
(6)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4,在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图:由图可知Co2+、Ni2+两种离子中催化效果更好的是_______ 。

(7)Ni位于第Ⅷ族,同位于第Ⅷ族的钌及其化合物在合成工业有广泛用途,下图是用钌(Ru)基催化剂催化合成甲酸的过程,每生成92g液态HCOOH放出62.4kJ的热量。下列说法正确的是_______ 。

a.反应的活化能为62.4 kJ·mol-1
b.图示中物质I为该反应的催化剂
c.图示中参与循环的物质只有CO2和H2

已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法
(2)加入H2O2发生的主要反应的离子方程式为
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25°C时Ksp(CaF2)= 1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5mol·L-1],则“除钙”时需控制混合溶液中F的浓度至少为
(5)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为
(6)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4,在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图:由图可知Co2+、Ni2+两种离子中催化效果更好的是

(7)Ni位于第Ⅷ族,同位于第Ⅷ族的钌及其化合物在合成工业有广泛用途,下图是用钌(Ru)基催化剂催化合成甲酸的过程,每生成92g液态HCOOH放出62.4kJ的热量。下列说法正确的是

a.反应的活化能为62.4 kJ·mol-1
b.图示中物质I为该反应的催化剂
c.图示中参与循环的物质只有CO2和H2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO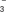 还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
①N2的电子式为________ 。
②上述反应离子方程式为____________ ,其平均反应速率v(NO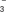 )=
)=_____ mol·L-1·min-1。
③还原过程中可生成中间产物NO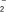 ,写出三种促进NO
,写出三种促进NO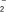 水解的方法:
水解的方法:______________ 。
(2)电化学降解NO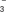 的原理如图所示。
的原理如图所示。
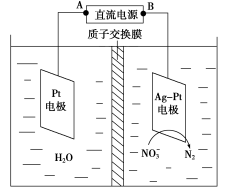
①电源正极为________ (填“A”或“B”),阴极反应式为_______________ 。
②若电解过程中转移了2 mol电子,则质子交换膜两侧电解液的质量变化差(Δm左-Δm右)为________ g。
(1)催化反硝化法中,H2能将NO
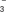 还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。①N2的电子式为
②上述反应离子方程式为
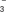 )=
)=③还原过程中可生成中间产物NO
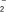 ,写出三种促进NO
,写出三种促进NO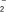 水解的方法:
水解的方法:(2)电化学降解NO
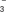 的原理如图所示。
的原理如图所示。
①电源正极为
②若电解过程中转移了2 mol电子,则质子交换膜两侧电解液的质量变化差(Δm左-Δm右)为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】金属回收与利用有利于环境保护。以某废渣(主要含Cd,还含少量Zn、Cu、Fe、Co等单质)为原料回收Cd,工艺流程如图所示:

已知几种金属离子沉淀的pH如表所示。
请回答下列问题:
(1)“酸浸”中加入稀硫酸,充分反应后过滤得到滤渣1的主要成分是_______ (填化学式)。
(2)“除钴”时,向含Co2+的浸液中加入Zn和Sb2O3,恰好产生CoSb合金,写出该反应的离子方程式:_______ 。若将该反应设计成原电池,锌在_______ 极发生反应。
(3)“除铁”时,先加入KMnO4氧化Fe2+ ,后加ZnO调溶液pH。加入ZnO调节溶液pH的范围为_______ 。 过滤,得滤渣2为MnO2和_______ (填化学式)。
(4)“电解”过程中以石墨为电极得到粗镉的电解总反应的化学方程式为_______ 。
(5)已知:常温下,Ksp[Cd(OH)2]≈2.0×10-16.如果用生石灰处理含Cd2+的电解废液,当pH=10时,c(Cd2+)=_______ mol/L。

已知几种金属离子沉淀的pH如表所示。
| 离子 | Fe3+ | Fe2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 完全沉淀的pH | 3.3 | 9.9 | ? |
请回答下列问题:
(1)“酸浸”中加入稀硫酸,充分反应后过滤得到滤渣1的主要成分是
(2)“除钴”时,向含Co2+的浸液中加入Zn和Sb2O3,恰好产生CoSb合金,写出该反应的离子方程式:
(3)“除铁”时,先加入KMnO4氧化Fe2+ ,后加ZnO调溶液pH。加入ZnO调节溶液pH的范围为
(4)“电解”过程中以石墨为电极得到粗镉的电解总反应的化学方程式为
(5)已知:常温下,Ksp[Cd(OH)2]≈2.0×10-16.如果用生石灰处理含Cd2+的电解废液,当pH=10时,c(Cd2+)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】铁及其化合物在催化、生产中具有重要作用。
(1)以 和
和 为原料,熔融
为原料,熔融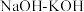 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在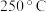 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。
①基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:___________ 和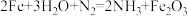 。
。
(2)在 催化作用下,合成氨反应
催化作用下,合成氨反应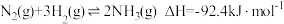 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):
化学吸附: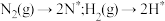 ;
;
表面反应: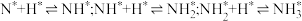 ;
;
脱附:
其中, 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
实际生产中,常用工艺条件, 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强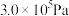 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为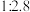 。
。
①分析说明原料气中 过量的理由
过量的理由___________ 。
②关于合成氨工艺的下列理解,正确的是___________ 。
A.控制温度( )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
B.当温度、压强一定时,在原料气( 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
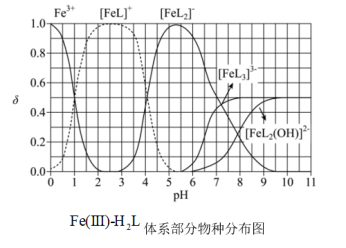
(3)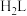 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其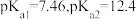 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中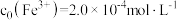 ,
,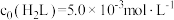 。体系中含
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数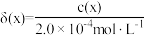 。
。 时,
时,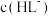
___________ 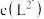 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
②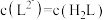 时,
时,
___________ ;
③当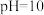 时,参与配位的
时,参与配位的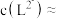
___________  (写出计算过程)。
(写出计算过程)。
(1)以
 和
和 为原料,熔融
为原料,熔融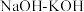 为电解质,纳米
为电解质,纳米 作催化剂,在
作催化剂,在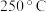 和常压下可实现电化学合成氨。
和常压下可实现电化学合成氨。①基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为②阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:
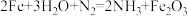 。
。(2)在
 催化作用下,合成氨反应
催化作用下,合成氨反应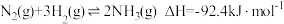 的反应历程为(*表示吸附态):
的反应历程为(*表示吸附态):化学吸附:
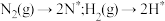 ;
;表面反应:
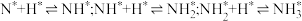 ;
;脱附:

其中,
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中,常用工艺条件,
 作催化剂,控制温度
作催化剂,控制温度 ,压强
,压强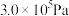 ,原料中
,原料中 和
和 物质的量之比为
物质的量之比为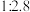 。
。①分析说明原料气中
 过量的理由
过量的理由②关于合成氨工艺的下列理解,正确的是
A.控制温度(
 )远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率B.当温度、压强一定时,在原料气(
 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率C.基于
 有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行D.分离空气可得
 ,通过天然气和水蒸气转化可得
,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。(3)
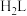 为某邻苯二酚类配体,其
为某邻苯二酚类配体,其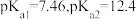 。常温下构建
。常温下构建 溶液体系,其中
溶液体系,其中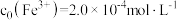 ,
,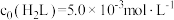 。体系中含
。体系中含 物种的组分分布系数
物种的组分分布系数 与
与 的关系如图所示,分布系数
的关系如图所示,分布系数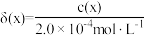 。
。
 时,
时,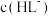
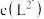 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②
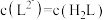 时,
时,
③当
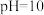 时,参与配位的
时,参与配位的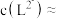
 (写出计算过程)。
(写出计算过程)。
您最近一年使用:0次




