氮的氧化物是造成大气污染的主要成分之一,降低氮氧化物的排放可改善大气质量。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g) N2(g)+2CO2(g) △H3=-747kJ•mol-1
N2(g)+2CO2(g) △H3=-747kJ•mol-1
碳完全燃烧时的热化学方程式为______ 。
(2)向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。
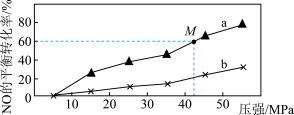
①曲线a、b对应温度较低的是______ (填“曲线a”或“曲线b”)。
②M点时混合气体的平均相对分子质量为______ (结果保留两位小数)。
(3)一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。
①反应开始到刚达平衡状态的时间段内,v(CO)=______ kPa·min-1,该反应条件下的平衡常数Kp=_____ (kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。该反应中正反应速率v正=k正·p2(NO)·p2(CO),逆反应速率v逆=k逆·p(N2)·p2(CO2),则该温度下,该反应的k正_____ (填“>”“<”或“=”)k逆。
②能判断反应已达到化学平衡状态的是______ (填字母序号)。
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
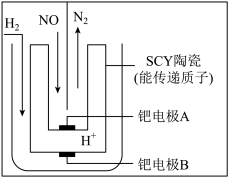
(4)工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为______ 。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H3=-747kJ•mol-1
N2(g)+2CO2(g) △H3=-747kJ•mol-1碳完全燃烧时的热化学方程式为
(2)向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。

①曲线a、b对应温度较低的是
②M点时混合气体的平均相对分子质量为
(3)一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| p/kPa | 200 | 185 | 173 | 165 | 160 | 160 |
②能判断反应已达到化学平衡状态的是
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
(4)工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为

更新时间:2023-05-16 22:22:15
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇是有机化工中重要的合成原料,在催化剂的作用下利用甲醇合成乙烯和丙烯的技术被称为MTO技术。该技术涉及的主要反应为:
ⅰ.
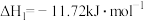 ;
;
ⅱ.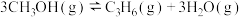
 。
。
请回答下列问题:
(1)反应 的反应热
的反应热
______  。
。
(2)在特定催化剂条件下,两反应存在竞争关系,其反应进程中能量的变化如图所示。其中N代表______ (填“ ”或“
”或“ ”,下同),该催化剂下,生成
”,下同),该催化剂下,生成______ 的选择性更高,理由为______ 。

(3)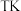 时,在体积为
时,在体积为 的恒容密闭容器中充入
的恒容密闭容器中充入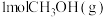 发生反应ⅰ和反应ⅱ,
发生反应ⅰ和反应ⅱ, 后压强变为原来的1.3倍后不再变化,此时测得
后压强变为原来的1.3倍后不再变化,此时测得 的物质的量浓度为
的物质的量浓度为 。
。
① 内
内 的生成速率为
的生成速率为______ 。
②平衡时 的物质的量浓度为
的物质的量浓度为______ 。
③升高温度后, 的平衡产率反而提高,分析原因为
的平衡产率反而提高,分析原因为______ 。
ⅰ.

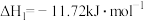 ;
;ⅱ.
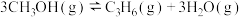
 。
。请回答下列问题:
(1)反应
 的反应热
的反应热
 。
。(2)在特定催化剂条件下,两反应存在竞争关系,其反应进程中能量的变化如图所示。其中N代表
 ”或“
”或“ ”,下同),该催化剂下,生成
”,下同),该催化剂下,生成
(3)
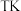 时,在体积为
时,在体积为 的恒容密闭容器中充入
的恒容密闭容器中充入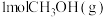 发生反应ⅰ和反应ⅱ,
发生反应ⅰ和反应ⅱ, 后压强变为原来的1.3倍后不再变化,此时测得
后压强变为原来的1.3倍后不再变化,此时测得 的物质的量浓度为
的物质的量浓度为 。
。①
 内
内 的生成速率为
的生成速率为②平衡时
 的物质的量浓度为
的物质的量浓度为③升高温度后,
 的平衡产率反而提高,分析原因为
的平衡产率反而提高,分析原因为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.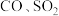 等烟道气对环境有污染,需经处理后才能排放,处理含
等烟道气对环境有污染,需经处理后才能排放,处理含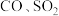 烟道气的一种方法是将其在催化剂作用下转化为单质
烟道气的一种方法是将其在催化剂作用下转化为单质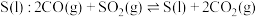
 。回答下列问题:
。回答下列问题:
(1)已知CO的燃烧热为
 ,
,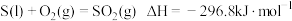 。则上述反应的
。则上述反应的
 。
。(2)其他条件相同、催化剂不同时发生上述反应。
 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。 和NiO作催化剂均能使
和NiO作催化剂均能使 的转化率达到最高,不考虑催化剂价格因素,选择
的转化率达到最高,不考虑催化剂价格因素,选择 的主要优点是
的主要优点是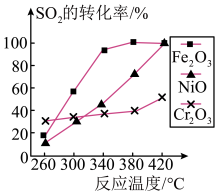
(3)在密闭容器中,充入
 和
和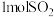 ,发生上述反应,
,发生上述反应, 的平衡转化率随温度、压强的变化如图所示。
的平衡转化率随温度、压强的变化如图所示。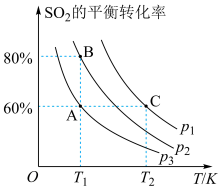
①B点对应条件下,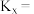

 ,x为物质的量分数]。
,x为物质的量分数]。
②A点和C点的压强平衡常数之比
Ⅱ.烟气中常含有大量 和
和 等大气污染物,需经过净化处理后才能排放。除去燃煤产生的废气中的
等大气污染物,需经过净化处理后才能排放。除去燃煤产生的废气中的 的过程如图所示。
的过程如图所示。
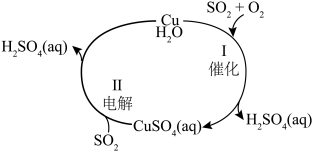
(4)过程Ⅰ是
 发生催化氧化反应,若参加反应
发生催化氧化反应,若参加反应 和
和 的体积比为4∶3,则反应的化学方程式为
的体积比为4∶3,则反应的化学方程式为(5)过程Ⅱ利用电化学装置吸收另一部分
 ,使Cu再生,该过程中阳极的电极反应式为
,使Cu再生,该过程中阳极的电极反应式为若此过程中除去 体积分数为0.5%的废气2240L(标准状况),可使
体积分数为0.5%的废气2240L(标准状况),可使 Cu再生。
Cu再生。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下面能量变化示意图,请写出NO和CO2反应的热化学方程式:_______ 。

(2)肼(N2H4)是火箭发动机的燃料,它与N2O4反应,生成氮气和水蒸气。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
①则肼跟N2O4反应的热化学方程式为_______ 。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,其电解质是20%-30%的KOH溶液,该电池的其负极反应为_______ 。消耗0.1mol肼,需通入空气的体积为_______ (标准状况,空气中氧气的体积分数为20%)。
(3)工业合成氨是重要的化工反应,一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的9/10,则N2的转化率 (N2)=
(N2)=_______
(4)汽车尾气中存在NO和NO2是大气污染物。已知反应N2O4(g) 2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是_______ 。

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(1)根据下面能量变化示意图,请写出NO和CO2反应的热化学方程式:

(2)肼(N2H4)是火箭发动机的燃料,它与N2O4反应,生成氮气和水蒸气。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
①则肼跟N2O4反应的热化学方程式为
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,其电解质是20%-30%的KOH溶液,该电池的其负极反应为
(3)工业合成氨是重要的化工反应,一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的9/10,则N2的转化率
 (N2)=
(N2)=(4)汽车尾气中存在NO和NO2是大气污染物。已知反应N2O4(g)
 2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸是重要的化工原料,可用于生产化肥、农药等。工业上一般以硫黄或其他含硫矿物(如黄铁矿)为原料来制备硫酸,其简易生产流程如图。回答下列问题:

(1)为了提高黄铁矿的燃烧效率,可采取的措施是___________ (写出一种即可)。
(2)黄铁矿 燃烧时发生反应的化学方程式为
燃烧时发生反应的化学方程式为___________ 。
(3)一定条件下,在2L的恒容密闭容器中进行 转化为
转化为 的反应,各组分浓度随时间的变化如表所示。
的反应,各组分浓度随时间的变化如表所示。
①0~20min内,v(SO3)=___________  。
。
②达到平衡时,反应中转移的总电子数为___________  。
。
③仅改变下列条件,化学反应速率增大的是___________ (填标号)。
A.升高温度
B.保持体积不变,充入He使体系压强增大
C.保持压强不变,充入He使容器的体积增大
④下列选项能说明上述反应已达平衡状态的是___________ (填标号)。
A. B.
B.
C.容器中气体密度不随时间的变化而变化 D.容器中 浓度不随时间的变化而变化
浓度不随时间的变化而变化
(4)以铜和硫酸为原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即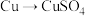 。
。
方案乙:通过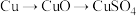 来制取硫酸铜。
来制取硫酸铜。
①方案甲中,铜和浓硫酸反应体现了浓硫酸的___________ 性。
②这两种方案,更合理的是方案___________ (填“甲”或“乙”),解释其原因:___________ 。

(1)为了提高黄铁矿的燃烧效率,可采取的措施是
(2)黄铁矿
 燃烧时发生反应的化学方程式为
燃烧时发生反应的化学方程式为(3)一定条件下,在2L的恒容密闭容器中进行
 转化为
转化为 的反应,各组分浓度随时间的变化如表所示。
的反应,各组分浓度随时间的变化如表所示。| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
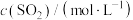 | 1.0 | 0.6 | 0.3 | 0.2 | 0.16 | 0.1 | 0.1 | 0.1 |
 | 0.5 | 0.3 | 0.15 | 0.1 | 0.07 | 0.05 | 0.05 | 0.05 |
 。
。②达到平衡时,反应中转移的总电子数为
 。
。③仅改变下列条件,化学反应速率增大的是
A.升高温度
B.保持体积不变,充入He使体系压强增大
C.保持压强不变,充入He使容器的体积增大
④下列选项能说明上述反应已达平衡状态的是
A.
 B.
B.
C.容器中气体密度不随时间的变化而变化 D.容器中
 浓度不随时间的变化而变化
浓度不随时间的变化而变化(4)以铜和硫酸为原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即
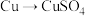 。
。方案乙:通过
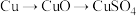 来制取硫酸铜。
来制取硫酸铜。①方案甲中,铜和浓硫酸反应体现了浓硫酸的
②这两种方案,更合理的是方案
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】化学是人类进步的阶梯,化学在生产、生活中有着广泛的应用。
(1)我国政府曾经向全世界郑重承诺,努力争取在2060年前实现碳中和,有人设计利用反应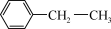 (乙苯,g)+CO2(g)
(乙苯,g)+CO2(g) 
 (苯乙烯,g)+CO(g)+H2O(g),实现二氧化碳的转化利用。
(苯乙烯,g)+CO(g)+H2O(g),实现二氧化碳的转化利用。
①恒温恒容的条件下进行上述反应,下列事实不能作为该反应达到平衡的依据的是___________ (填字母)。
a.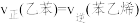 b.容器内气体密度不再变化
b.容器内气体密度不再变化
c.容器内气体的平均相对分子质量不再变化 d.苯乙烯的体积分数不再变化
e.容器内苯乙烯与 的浓度相等
的浓度相等
②一定温度下,将2mol 和
和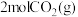 加入固定体积为
加入固定体积为 密闭容器中,发生上述反应。
密闭容器中,发生上述反应。 后达到平衡,测得
后达到平衡,测得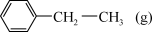 为
为 ,
, 内的平均反应速率
内的平均反应速率
___________  。
。
(2)某兴趣小组探究化学反应速率和平衡。在一定温度下,向2L固定体积的密闭容器中充入 ,发生反应
,发生反应 ,测得容器内
,测得容器内 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。

①图中1~4四个点中,到达平衡状态的是___________ 。
②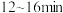 内,用A表示的化学反应速率为
内,用A表示的化学反应速率为___________  。
。
③反应进行到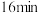 时,A的转化率是
时,A的转化率是___________ 。
④上述条件下,下列措施能使该反应速率加快的是___________ 。
A.继续加入A B.增大容器体积 C.加入合适的催化剂 D.充入一定量的
(3)工业上利用反应 消除污染,在不同条件下的化学反应速率如下:
消除污染,在不同条件下的化学反应速率如下:
① ②
②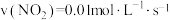
③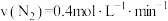 ④
④
上述表示的化学反应速率由快到慢的顺序为___________ 。
(1)我国政府曾经向全世界郑重承诺,努力争取在2060年前实现碳中和,有人设计利用反应
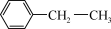 (乙苯,g)+CO2(g)
(乙苯,g)+CO2(g) 
 (苯乙烯,g)+CO(g)+H2O(g),实现二氧化碳的转化利用。
(苯乙烯,g)+CO(g)+H2O(g),实现二氧化碳的转化利用。①恒温恒容的条件下进行上述反应,下列事实不能作为该反应达到平衡的依据的是
a.
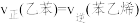 b.容器内气体密度不再变化
b.容器内气体密度不再变化c.容器内气体的平均相对分子质量不再变化 d.苯乙烯的体积分数不再变化
e.容器内苯乙烯与
 的浓度相等
的浓度相等②一定温度下,将2mol
 和
和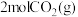 加入固定体积为
加入固定体积为 密闭容器中,发生上述反应。
密闭容器中,发生上述反应。 后达到平衡,测得
后达到平衡,测得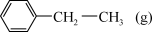 为
为 ,
, 内的平均反应速率
内的平均反应速率
 。
。(2)某兴趣小组探究化学反应速率和平衡。在一定温度下,向2L固定体积的密闭容器中充入
 ,发生反应
,发生反应 ,测得容器内
,测得容器内 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。
①图中1~4四个点中,到达平衡状态的是
②
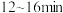 内,用A表示的化学反应速率为
内,用A表示的化学反应速率为 。
。③反应进行到
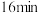 时,A的转化率是
时,A的转化率是④上述条件下,下列措施能使该反应速率加快的是
A.继续加入A B.增大容器体积 C.加入合适的催化剂 D.充入一定量的

(3)工业上利用反应
 消除污染,在不同条件下的化学反应速率如下:
消除污染,在不同条件下的化学反应速率如下:①
 ②
②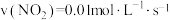
③
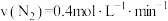 ④
④
上述表示的化学反应速率由快到慢的顺序为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】请根据要求回答相关问题:
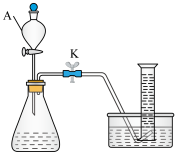
I.某小组用下图装置探究H2C2O₄溶液与酸性KMnO4溶液的反应(夹持装置略去)。
(1)仪器A的名称为___________ 。
(2)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为___________ 。
(3)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中最佳试剂为___________。
Ⅱ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(4)①T1=___________ ;V2=___________ 。
②若t1<8,则由此实验可以得出的结论是___________ 。
③忽略溶液体积的变化,利用实验②中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v=___________ 。(保留3个有效数字)
④H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用___________ 。

I.某小组用下图装置探究H2C2O₄溶液与酸性KMnO4溶液的反应(夹持装置略去)。
(1)仪器A的名称为
(2)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为
(3)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中最佳试剂为___________。
| A.饱和NaHCO3溶液 | B.饱和NaCl溶液 |
| C.水 | D.饱和Na2CO3溶液 |
Ⅱ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
| 实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol/L | V/mL | c/mol/L | V/mL | |||
| ① | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| ② | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| ③ | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(4)①T1=
②若t1<8,则由此实验可以得出的结论是
③忽略溶液体积的变化,利用实验②中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v=
④H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】煤的间接液化是煤的综合利用的一种重要方法。首先是煤燃烧生成 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:
反应Ⅰ: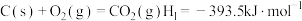
反应Ⅱ: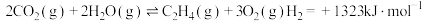
反应Ⅲ: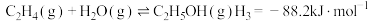
1.已知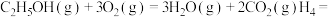
___________ 。
2.反应Ⅰ中属于共价化合物的电子式:___________ 。
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在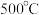 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
4.如图为四种组分的平衡时物质的量分数随温度的变化曲线。图中曲线 表示的物质是
表示的物质是___________ ,原因是___________ 。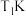 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和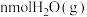 ,同时加入了
,同时加入了 和
和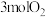 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
___________ (用含 的代数式表示)。
的代数式表示)。
 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:反应Ⅰ:
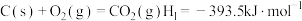
反应Ⅱ:
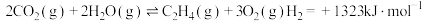
反应Ⅲ:
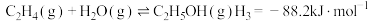
1.已知
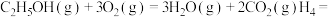
2.反应Ⅰ中属于共价化合物的电子式:
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个
 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
A. 的体积分数不再改变 的体积分数不再改变 | B. 不再改变 不再改变 |
| C.容器的总压不再改变 | D.容器中气体的密度不再改变 |
 表示的物质是
表示的物质是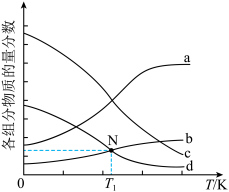
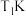 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和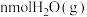 ,同时加入了
,同时加入了 和
和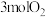 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮的循环在自然界中具有重要的意义。
(1)已知:①H2(g)+ O2(g)=H2O(l) △H=-285.8kJ·mol-1
O2(g)=H2O(l) △H=-285.8kJ·mol-1
②N2(g)+O2(g)⇌2NO(g) △H=+180.0kJ·mol-1
③6NO(g)+4NH3(g)⇌5N2(g)+6H2O(l) △H=-2070.0kJ·mol-1
则合成氨反应的热化学方程式为____________________ 。
(2)下列有关合成氨反应的说法正确的是__________ (填字母)。
A.反应温度控制在500℃左右能用勒夏特列原理解释
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.该反应的△H和△S都小于零
D.NH3易液化,不断将液氨移去,利于反应正向进行
E.催化剂能增大反应的平衡常数
(3)合成氨反应途径可简单地表示为:①Fe+N2→FexN △H>0;②FexN+H2→Fe+NH3△H<0。已知反应①和②的活化能分别为126kJ·mol-1和13kJ·mol-1,则合成氨反应的△H在有催化剂(a)和无催化剂(b)时反应过程能量变化图是__________(填字母)。
(4)一定条件下,在5L的恒容密闭容器中通入1mol N2与3mol H2,反应4min后达到平衡时H2为1.5mol。若初始压强为P0,反应过程中容器内总压强(P)随时间(t)变化如图所示(平衡时温度与初始温度相同)。
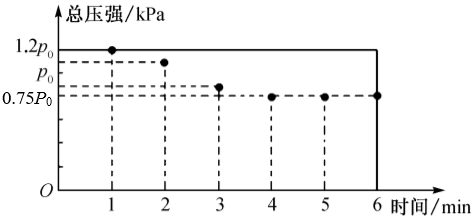
①0~1min容器内压强增大的原因为__________ 。
②用平衡分压代替平衡浓度表示平衡常数的KP的计算式为__________ (气体分压=总压×物质的量分数)。
(5)将一定比例的N2和H2的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时,N2的转化率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内,随温度升高,N2的转化率迅速上升的主要原因是__________ 。
②当反应温度高于380℃时,N2的转化率迅速下降的主要原因可能是__________ 。
(1)已知:①H2(g)+
 O2(g)=H2O(l) △H=-285.8kJ·mol-1
O2(g)=H2O(l) △H=-285.8kJ·mol-1②N2(g)+O2(g)⇌2NO(g) △H=+180.0kJ·mol-1
③6NO(g)+4NH3(g)⇌5N2(g)+6H2O(l) △H=-2070.0kJ·mol-1
则合成氨反应的热化学方程式为
(2)下列有关合成氨反应的说法正确的是
A.反应温度控制在500℃左右能用勒夏特列原理解释
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.该反应的△H和△S都小于零
D.NH3易液化,不断将液氨移去,利于反应正向进行
E.催化剂能增大反应的平衡常数
(3)合成氨反应途径可简单地表示为:①Fe+N2→FexN △H>0;②FexN+H2→Fe+NH3△H<0。已知反应①和②的活化能分别为126kJ·mol-1和13kJ·mol-1,则合成氨反应的△H在有催化剂(a)和无催化剂(b)时反应过程能量变化图是__________(填字母)。
A.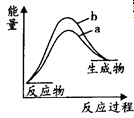 | B.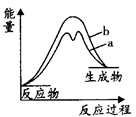 |
C.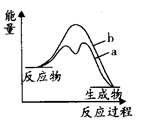 | D.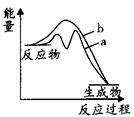 |

①0~1min容器内压强增大的原因为
②用平衡分压代替平衡浓度表示平衡常数的KP的计算式为
(5)将一定比例的N2和H2的混合气体匀速通入装有催化剂的反应器中反应,反应相同时间时,N2的转化率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内,随温度升高,N2的转化率迅速上升的主要原因是
②当反应温度高于380℃时,N2的转化率迅速下降的主要原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】天然气的主要成分为CH4,还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g) C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:
C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:
①ΔH=___________ kJ•mol-1。
②提高该反应平衡转化率的方法有___________ 、___________ 。
(2)密闭容器中通入等物质的量的乙烷和氢气,在等温等压下(p)发生上述反应C2H6(g) C2H4(g)+H2(g)。
C2H4(g)+H2(g)。
①可判断该反应达平衡的标志为___________ (填选项字母)。
A.容器内混合气体的密度恒定
B.容器内混合气体的压强恒定
C.容器内乙烷和氢气的物质的量之比恒定
D.生成乙烯的速率和乙烷消耗的速率相等
②如果乙烷的平衡转化率为α,反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=___________ r1。
(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:___________ 。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为___________ 。
(1)乙烷在一定条件可发生如下反应:C2H6(g)
 C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:
C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH/(kJ•mol-1) | —1560 | —1411 | —286 |
②提高该反应平衡转化率的方法有
(2)密闭容器中通入等物质的量的乙烷和氢气,在等温等压下(p)发生上述反应C2H6(g)
 C2H4(g)+H2(g)。
C2H4(g)+H2(g)。①可判断该反应达平衡的标志为
A.容器内混合气体的密度恒定
B.容器内混合气体的压强恒定
C.容器内乙烷和氢气的物质的量之比恒定
D.生成乙烯的速率和乙烷消耗的速率相等
②如果乙烷的平衡转化率为α,反应的平衡常数Kp=
(3)高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
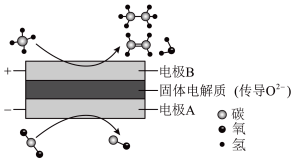
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g) 2NH3(g)的平衡常数K=
2NH3(g)的平衡常数K=_____ (精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______ (填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1) 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
(1)此合成反应的a_____ 0;ΔS______ 0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g) 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______ (用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______ 。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)
 2NH3(g)的平衡常数K=
2NH3(g)的平衡常数K=A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)
 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:| T/K | 303 | 313 | 323 |
| NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a
(2)已知(K为平衡常数):N2(g)+3H2(g)
 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CH4、NH3、H2O、HF是第二周期的氢化物,也是生产生活中的重要物质。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为________________ 。
(2) NH3和H2O中稳定性较高的是:___________ ,NH3和PH3中沸点较高的是:__________ 。
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

①装置中气体A为________ (填“CH4”或“O2和CO2”),d极上的电极反应式为_______________________________________ 。
②乙装置中a极上的电极反应式为___________________ 。
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4________ mL(标准状况),乙装置中所得溶液的pH=________ (忽略电解前后溶液体积变化)。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为
(2) NH3和H2O中稳定性较高的是:
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

①装置中气体A为
②乙装置中a极上的电极反应式为
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】如图所示某小组为研究电化学原理,设计如图所示装置。根据原电池原理回答下列问题:

(1)若a和b不连接时,铁片上发生的反应为_______ 。
(2)①若a和b用导线连接时,_______ (填“Cu”或“Fe”)作负极,负极发生的电极反应为_______ ,溶液中SO 离子向
离子向_______ 极移动(填“Cu”或“Fe”)。
②若起始时铁和铜的质量相等,硫酸铜溶液的体积为500mL,将a和b用导线连接。一段时间后,铁片和铜片质量相差1.2g,则导线中流过电子的物质的量为_______ mol(不考虑其他形式能量转化)。
(3)锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
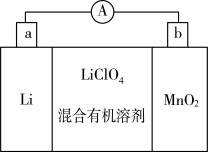
①电池正极反应式为_______ ,每转移2mol电子,生成_______ gLiMnO2。
②不能用水代替电池中的混合有机溶剂,原因是_______ 。
③MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,该反应的化学方程式为_______ 。

(1)若a和b不连接时,铁片上发生的反应为
(2)①若a和b用导线连接时,
 离子向
离子向②若起始时铁和铜的质量相等,硫酸铜溶液的体积为500mL,将a和b用导线连接。一段时间后,铁片和铜片质量相差1.2g,则导线中流过电子的物质的量为
(3)锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

①电池正极反应式为
②不能用水代替电池中的混合有机溶剂,原因是
③MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,该反应的化学方程式为
您最近一年使用:0次



