实验室常用如下左装置制取溴乙烷。在圆底烧瓶中加入溴化钠、浓 、乙醇和适量的水,加热可收集到溴乙烷。所涉及的有关物质的物理性质见下表:
、乙醇和适量的水,加热可收集到溴乙烷。所涉及的有关物质的物理性质见下表:

(1)写出有机化合物所含官能团名称。溴乙烷:_______ ;乙醇:_______ 。
(2)完成用此法制备溴乙烷的反应式:
① ;
;
②_______ 
_______ 。
其中反应②是一个可逆反应,在实验中采取的措施_______ (任写一种),以提高溴乙烷的产率。
(3)反应时若温度过高,可看到有红棕色气体产生,其成分为_______ (写分子式)。为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______ 。
(4)反应物中加入适量水,除了溶解NaBr使反应物接触更充分外,还可以_______ (双选)。
a.降低硫酸浓度,减少副反应 b.减少HBr的挥发
c.使反应混合物分层 d.防止反应体系温度过高
(5)烧瓶中除了加入反应物外,还需加入几片碎瓷片,目的是_______ 。实验进行的途中若发现未加入碎瓷片,正确的处理方法是_______ 。
(6)下列最适宜作为溴乙烷收集装置的是_______ 。
(7)制得的粗溴乙烷中会含有少量 而呈黄色,可先用
而呈黄色,可先用 溶液洗涤,再水洗干燥后
溶液洗涤,再水洗干燥后_______ (填操作名称)。洗涤过程用到的主要玻璃仪器是_______ 。
(8)完成 溶液洗涤时发生反应的离子方程式并标明电子转移方向和数目:
溶液洗涤时发生反应的离子方程式并标明电子转移方向和数目:_______ 。
 _______
_______
(9)能否改用NaOH溶液洗涤粗溴乙烷?说明原因_______ 。
(10)检验溴乙烷官能团的正确操作顺序是:取少量溴乙烷,然后_______ (填代号)。
①加热;②加入 溶液;③加入稀
溶液;③加入稀 酸化;④加入NaOH溶液;⑤冷却
酸化;④加入NaOH溶液;⑤冷却
 、乙醇和适量的水,加热可收集到溴乙烷。所涉及的有关物质的物理性质见下表:
、乙醇和适量的水,加热可收集到溴乙烷。所涉及的有关物质的物理性质见下表:
| 乙醇 | 溴乙烷 | |
| 沸点(℃) | 78 | 38.4 |
密度( ) ) | 0.79 | 1.45 |
| 水溶性 | 互溶 | 不溶 |
(2)完成用此法制备溴乙烷的反应式:
①
 ;
;②

其中反应②是一个可逆反应,在实验中采取的措施
(3)反应时若温度过高,可看到有红棕色气体产生,其成分为
(4)反应物中加入适量水,除了溶解NaBr使反应物接触更充分外,还可以
a.降低硫酸浓度,减少副反应 b.减少HBr的挥发
c.使反应混合物分层 d.防止反应体系温度过高
(5)烧瓶中除了加入反应物外,还需加入几片碎瓷片,目的是
(6)下列最适宜作为溴乙烷收集装置的是
 | 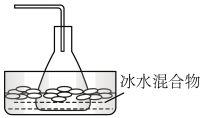 | 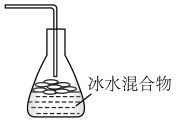 |  |
| a | b | c | d |
 而呈黄色,可先用
而呈黄色,可先用 溶液洗涤,再水洗干燥后
溶液洗涤,再水洗干燥后(8)完成
 溶液洗涤时发生反应的离子方程式并标明电子转移方向和数目:
溶液洗涤时发生反应的离子方程式并标明电子转移方向和数目: _______
_______
(9)能否改用NaOH溶液洗涤粗溴乙烷?说明原因
(10)检验溴乙烷官能团的正确操作顺序是:取少量溴乙烷,然后
①加热;②加入
 溶液;③加入稀
溶液;③加入稀 酸化;④加入NaOH溶液;⑤冷却
酸化;④加入NaOH溶液;⑤冷却
更新时间:2023-09-04 14:41:42
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

(1)反应I的化学方程式是__________ ,其中 的电子式
的电子式___________ 。
(2)若反应I得到的 ;浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
;浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________
(3)反应I需控制反应温度低于35℃,其目的是____________ 。
(4)反应I的反应类型为______________________ 。
(5)反应Ⅲ常被用于电解生产 (过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为
(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_______ 。
(6)已知煅烧 的化学方程式是
的化学方程式是 ,现煅烧
,现煅烧 的
的 ,得到
,得到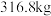 产品。若产品中仅仅有杂质
产品。若产品中仅仅有杂质 ,则该产品中
,则该产品中 的质量是
的质量是________ kg。

(1)反应I的化学方程式是
 的电子式
的电子式(2)若反应I得到的
 ;浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
;浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是(3)反应I需控制反应温度低于35℃,其目的是
(4)反应I的反应类型为
(5)反应Ⅲ常被用于电解生产
 (过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为
(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为(6)已知煅烧
 的化学方程式是
的化学方程式是 ,现煅烧
,现煅烧 的
的 ,得到
,得到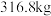 产品。若产品中仅仅有杂质
产品。若产品中仅仅有杂质 ,则该产品中
,则该产品中 的质量是
的质量是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】下图为各单质与化合物之间的转化关系,单质及化合物的组成元素均为常见的短周期元素。请回答:

(1)若沉淀丁不溶于过量的盐酸,单质A为_______ 。若沉淀丁能溶于过量的盐酸,化合物甲为_______ 。
(2)单质B的化学式为_______ ,丙的电子式为_______ 。
(3)若沉淀丁不溶于过量的盐酸,写出A和NaOH溶液反应的化学方程式:_______ 。
(4)KMnO4是重要的氧化剂,在双氧水中滴加少量用稀硫酸酸化的KMnO4溶液,溶液迅速变为无色,同时生成单质B。写出该反应的离子方程式_______ 。
(5)单质B的同素异体与Na2FeO4同是良好的消毒剂,在新冠疫情防控中作用巨大。在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为_______ 。

(1)若沉淀丁不溶于过量的盐酸,单质A为
(2)单质B的化学式为
(3)若沉淀丁不溶于过量的盐酸,写出A和NaOH溶液反应的化学方程式:
(4)KMnO4是重要的氧化剂,在双氧水中滴加少量用稀硫酸酸化的KMnO4溶液,溶液迅速变为无色,同时生成单质B。写出该反应的离子方程式
(5)单质B的同素异体与Na2FeO4同是良好的消毒剂,在新冠疫情防控中作用巨大。在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
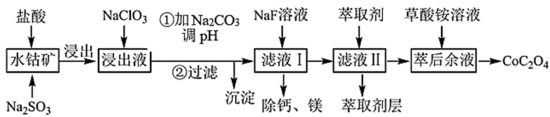
【推荐3】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为增大水钴矿的浸取效率,可采取的措施为______ 。(任写一条)
(2)向浸出液中加入NaClO3对应的离子反应方程式为______ ,制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为______ ;实验需要制取21.3克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为______ (标准状况)。
(3)向浸出液中加入碳酸钠后析出的沉淀是______ ,至少调节pH为______ 。
(4)滤液Ⅱ中加入萃取剂的目的是______ 。
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液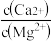 =
=______ 。
(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为_______ 。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)为增大水钴矿的浸取效率,可采取的措施为
(2)向浸出液中加入NaClO3对应的离子反应方程式为
(3)向浸出液中加入碳酸钠后析出的沉淀是
(4)滤液Ⅱ中加入萃取剂的目的是
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
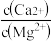 =
=(6)取15gCoC2O4样品灼烧(CoC2O4=CoO+CO+CO2,假设杂质不参与变化),将分解产生的气体收集起来得到标况下体积为4.48L的气体,则CoC2O4的纯度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g) N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________ (用含△H1和△H2的代数式表示)。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。
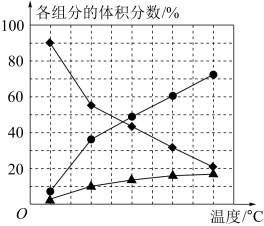
该反应的△H________ (填“>”或“<”)0,N2H4发生分解反应的化学方程式为___________ 。
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。
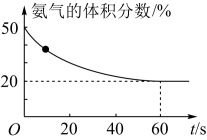
① 0~60s内,反应速率v(CO2)=________ mol/(L·s)
② T℃时,该反应的化学平衡常数K=________ 。
(1)①N2H4 (g)
 N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1②N2(g)+3H2(g)
 2NH3(g) △H2
2NH3(g) △H2③7N2H4(g)
 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3△H3=
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。

① 0~60s内,反应速率v(CO2)=
② T℃时,该反应的化学平衡常数K=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
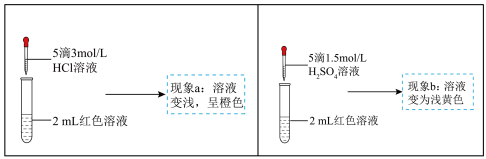
【推荐2】实验小组探究酸对 平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1) 水解显酸性的原因是
水解显酸性的原因是_____ (用方程式表示)。
(2)甲同学认为加入酸后,会使 体系中
体系中_____ 浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
① 和
和 、
、 均能发生络合反应:
均能发生络合反应:
 (黄色);
(黄色); (无色)。
(无色)。
②0.005mol/L时, 显无色。
显无色。
实验I.探究现象a中溶液颜色变化的原因
(3)实验①的目的是_____ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:_____ 。
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是 和
和_____
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒不是 ,请将实验④的操作及现象补充完整:
,请将实验④的操作及现象补充完整:_____ 、_____ 。
 平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
平衡的影响。将0.005mol/LFeCl3溶液(接近无色)和0.01mol/LKSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)
 水解显酸性的原因是
水解显酸性的原因是(2)甲同学认为加入酸后,会使
 体系中
体系中【设计并实施实验】

【查阅资料】
①
 和
和 、
、 均能发生络合反应:
均能发生络合反应: (黄色);
(黄色); (无色)。
(无色)。②0.005mol/L时,
 显无色。
显无色。实验I.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol/LKCl溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol/L 溶液(无色),加入1mL0.01 溶液(无色),加入1mL0.01mol/LKSCN溶液,再加入5滴1.5mol/L  溶液 溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol/L 溶液,_____ 溶液,_____ | _____ |
 和
和(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒不是
 ,请将实验④的操作及现象补充完整:
,请将实验④的操作及现象补充完整:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氢气的制取与储存是氢能源利用领域的研究热点。CH4-H2O(g)催化重整制氢,主要反应如下:
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:
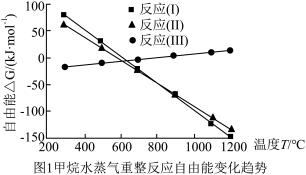
(1)反应Ⅱ焓变的符号:∆H2_______ 0(填“>”或“<”),理由是_______ 。
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是_______ 。
(3)反应Ⅲ的速率v=v正-v逆=k正c(CO)•c(H2O)-k逆c(CO2)•c(H2),其中k正、k逆分别为正、逆反应速率常数。升高温度时lgk正-lgk逆_______ (填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为_______ MPa(用含a、b的代数式表示,下同)。
②反应I的Kp=_______ (用平衡时各物质的分压代替物质的量浓度)。
(5)70~80℃,利用HCO 与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
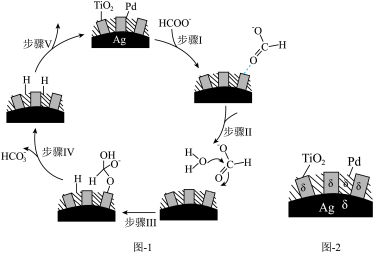
①写出释氢反应的离子方程式:_______ 。
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为_______ 。
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:

(1)反应Ⅱ焓变的符号:∆H2
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是
| A.及时分离出二氧化碳,可以使得反应I的正反应速率增大 |
| B.降低温度,反应I逆向移动,反应Ⅲ正向移动 |
| C.加入反应Ⅲ的催化剂,可以降低该反应的活化能和反应热 |
| D.增大水蒸气的浓度,有利于提高甲烷的平衡转化率 |
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为
②反应I的Kp=
(5)70~80℃,利用HCO
 与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
①写出释氢反应的离子方程式:
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】某兴趣小组对化合物X开展探究实验。

其中:常温常压下ⅹ是一种有特殊气味、易挥发的无色液体,由三种常见的短周期元素组成。
请回答:
(1)组成X的3种元素是_______ (填元素符号),沉淀C的化学式是_______ 。
(2)X反应生成A和B的反应方程式是_______ 。
(3)B可与乙醇以物质的量之比1∶2发生取代反应生成一种酯,写出反应方程式_______ 。
(4)实验室保存少量物质X的仪器是_______ 。
A.无色广口瓶 B.棕色广口瓶 C.无色细口瓶 D.棕色细口瓶
(5)请设计一种不同于上述流程的实验方案,检验中相对原子质量最大的元素_______ 。

其中:常温常压下ⅹ是一种有特殊气味、易挥发的无色液体,由三种常见的短周期元素组成。
请回答:
(1)组成X的3种元素是
(2)X反应生成A和B的反应方程式是
(3)B可与乙醇以物质的量之比1∶2发生取代反应生成一种酯,写出反应方程式
(4)实验室保存少量物质X的仪器是
A.无色广口瓶 B.棕色广口瓶 C.无色细口瓶 D.棕色细口瓶
(5)请设计一种不同于上述流程的实验方案,检验中相对原子质量最大的元素
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有甲、乙两种物质:

甲

 Y
Y 乙
乙
(1)乙中含有的官能团的名称为_______________ 。
(2)由甲转化为乙需经如图所示的过程(已略去各步反应的无关产物,下同):其中反应I的反应类型是________ ,反应II的条件是_______ ,反应III的化学方程式为__________ 。
(3)下列物质不能与乙反应的是_______ (选填序号)。
a.金属钠b.溴水d.乙酸
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式___________ 。
①苯环上的一氯代物只有1种 ②羟基连在苯环上③含有两个甲基
(5)欲证明乙中氯元素的存在,下列用到的步骤的先后顺序是____________ (填序号)。
①加入AgNO3溶液 ②加入NaOH水溶液,加热 ③加入稀硝酸至溶液呈酸性

甲


 Y
Y 乙
乙(1)乙中含有的官能团的名称为
(2)由甲转化为乙需经如图所示的过程(已略去各步反应的无关产物,下同):其中反应I的反应类型是
(3)下列物质不能与乙反应的是
a.金属钠b.溴水d.乙酸
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式
①苯环上的一氯代物只有1种 ②羟基连在苯环上③含有两个甲基
(5)欲证明乙中氯元素的存在,下列用到的步骤的先后顺序是
①加入AgNO3溶液 ②加入NaOH水溶液,加热 ③加入稀硝酸至溶液呈酸性
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】下图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置。有关数据见下表:
乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是___________(填序号,可多选)。
(2)图中试管C中的导管E的末端须在水面以下,其原因是___________ 。
(3)加热的目的是___________ 。
(4)为除去产品中的一种主要杂质,最好选择下列___________(填序号)溶液来洗涤产品。
(5)第(4)步的实验所需要的玻璃仪器有___________ 。

乙醇、溴乙烷、溴有关参数
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| A.减少副产物烯和醚的生成 | B.减少Br2的生成 |
| C.减少HBr的挥发 | D.水是反应的催化剂 |
(3)加热的目的是
(4)为除去产品中的一种主要杂质,最好选择下列___________(填序号)溶液来洗涤产品。
| A.氢氧化钠 | B.碘化亚铁 | C.亚硫酸钠 | D.碳酸氢钠 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
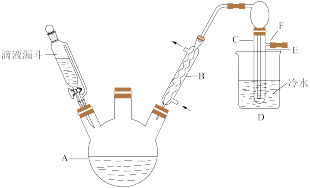
【推荐2】联苄( )是一种重要的有机合成中间体,实验室可用苯和1,
)是一种重要的有机合成中间体,实验室可用苯和1,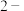 二氯乙烷为原料,在无水AlCl3催化下加热制得。查阅资料:
二氯乙烷为原料,在无水AlCl3催化下加热制得。查阅资料:
Ⅰ.催化剂(AlCl3)的制备:图中是实验室制取并收集少量无水AlCl3的相关实验装置的仪器和药品。

(1)制备无水AlCl3的导管接口顺序为d→___________ (填序号,不重复使用)。
(2)装置B中制氯气的化学方程式为___________ 。
(3)在选择收集装置时,常选用图中F,而不选择以下所给图的原因是___________ 。

Ⅱ.苄的制备:联苄的制取原理为: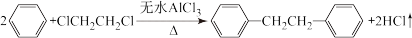 ,实验装置如图所示
,实验装置如图所示 加热和加持仪器略去
加热和加持仪器略去 :
:

实验步骤:
在三口烧瓶中加入120.0ml苯和适量无水AlCl3,由滴液漏斗滴加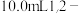 二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、
二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、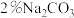 溶液和H2O洗涤分离,在所得产物中加入少量无水
溶液和H2O洗涤分离,在所得产物中加入少量无水 固体,静止、过滤,先常压蒸馏,再减压蒸馏收集
固体,静止、过滤,先常压蒸馏,再减压蒸馏收集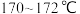 的馏分,得联苄
的馏分,得联苄 。
。
(4)依次用稀盐酸、碳酸钠溶液、水洗涤后均需要进行的操作是___________ 。
(5)洗涤操作中,水洗涤的主要目的是___________ 。
(6)常压蒸馏时,除去的杂质为___________ 。
(7)该实验的产率约为___________  计算结果保留3位有效数字
计算结果保留3位有效数字 。
。
 )是一种重要的有机合成中间体,实验室可用苯和1,
)是一种重要的有机合成中间体,实验室可用苯和1,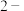 二氯乙烷为原料,在无水AlCl3催化下加热制得。查阅资料:
二氯乙烷为原料,在无水AlCl3催化下加热制得。查阅资料:| 名称 | 相对分子质量 | 密度/(g/mL) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.9 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯乙烷 | 99 | 1.3 | -35.5 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.4 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 1.0 | 52 | 284 | 难溶水,易溶苯 |

(1)制备无水AlCl3的导管接口顺序为d→
(2)装置B中制氯气的化学方程式为
(3)在选择收集装置时,常选用图中F,而不选择以下所给图的原因是

Ⅱ.苄的制备:联苄的制取原理为:
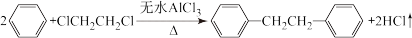 ,实验装置如图所示
,实验装置如图所示 加热和加持仪器略去
加热和加持仪器略去 :
:
实验步骤:
在三口烧瓶中加入120.0ml苯和适量无水AlCl3,由滴液漏斗滴加
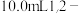 二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、
二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、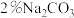 溶液和H2O洗涤分离,在所得产物中加入少量无水
溶液和H2O洗涤分离,在所得产物中加入少量无水 固体,静止、过滤,先常压蒸馏,再减压蒸馏收集
固体,静止、过滤,先常压蒸馏,再减压蒸馏收集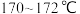 的馏分,得联苄
的馏分,得联苄 。
。(4)依次用稀盐酸、碳酸钠溶液、水洗涤后均需要进行的操作是
(5)洗涤操作中,水洗涤的主要目的是
(6)常压蒸馏时,除去的杂质为
(7)该实验的产率约为
 计算结果保留3位有效数字
计算结果保留3位有效数字 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】用如图所示实验装置制取乙酸乙酯。回答以下问题:

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:先向试管中加入一定量的_______ ,然后边振荡边缓缓加入_______ ,冷却后再加入一定量的_______ ,轻轻振荡使之混合均匀。
(2)浓硫酸的作用是:_______ 。
(3)饱和碳酸钠溶液的作用是:①_______ ;②_______ ;③_______ ;
(4)生成的乙酸乙酯,其密度比水_______ (填“大”或“小”),有_______ 味。
(5)若实验中反应温度不当,使反应温度维持在140℃左右,此时副反应的主要有机产物的结构简式为:_______ 。
(6)与书中采用的实验装置的不同之处是:本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中。在此处球形干燥管的作用有:①_______ ,②_______ 。

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:先向试管中加入一定量的
(2)浓硫酸的作用是:
(3)饱和碳酸钠溶液的作用是:①
(4)生成的乙酸乙酯,其密度比水
(5)若实验中反应温度不当,使反应温度维持在140℃左右,此时副反应的主要有机产物的结构简式为:
(6)与书中采用的实验装置的不同之处是:本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中。在此处球形干燥管的作用有:①
您最近一年使用:0次



