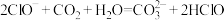按要求回答下列问题:
(1)pH=13的氢氧化钠与pH=2的硫酸溶液混合,所得混合液的pH= 11,则强碱与强酸的体积比为___________ 。
(2)25℃时,HA的电离常数K=1×10-6,则浓度均为0.01 mol/L的HA与NaA溶液等体积混合,则混合溶液呈___________ (填“酸”“碱”或“中”)性。
(3)79℃,0.01 mol/L的NaOH溶液的pH = 10,此时水的离子积为___________ 0.01mol/L的HB溶液的pH为5,则T℃时HB的电离常数K为___________ 。
(4)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式___________ 。
(5)25℃时,在浓度均为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其中c( )分别为a、b、c (mol/L),则a、b、c的大小关系
)分别为a、b、c (mol/L),则a、b、c的大小关系___________ 。
(1)pH=13的氢氧化钠与pH=2的硫酸溶液混合,所得混合液的pH= 11,则强碱与强酸的体积比为
(2)25℃时,HA的电离常数K=1×10-6,则浓度均为0.01 mol/L的HA与NaA溶液等体积混合,则混合溶液呈
(3)79℃,0.01 mol/L的NaOH溶液的pH = 10,此时水的离子积为
(4)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式
(5)25℃时,在浓度均为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其中c(
 )分别为a、b、c (mol/L),则a、b、c的大小关系
)分别为a、b、c (mol/L),则a、b、c的大小关系
更新时间:2023-11-24 15:18:35
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】25℃时,五种酸的电离平衡常数如下:
回答下列问题:
(1)少量的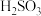 溶液和
溶液和 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ ;足量的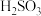 溶液和NaClO溶液发生反应的离子方程式为
溶液和NaClO溶液发生反应的离子方程式为_______ 。
(2)亚磷酸(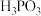 )为二元酸,
)为二元酸,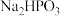 是
是_______ (填“酸式盐”、“碱式盐”或“正盐”)。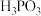 的第二级电离方程式为
的第二级电离方程式为_______ 。
(3)25℃时, 与
与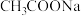 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中
,则溶液中
_______ (填准确数值)。
| 化学式 |  |  | HlClO | 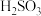 | 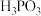 亚磷酸 亚磷酸 |
| 电离平衡常数 | 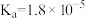 | 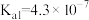 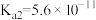 | 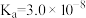 | 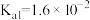 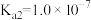 | 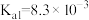 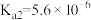 |
回答下列问题:
(1)少量的
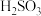 溶液和
溶液和 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为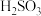 溶液和NaClO溶液发生反应的离子方程式为
溶液和NaClO溶液发生反应的离子方程式为(2)亚磷酸(
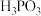 )为二元酸,
)为二元酸,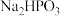 是
是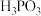 的第二级电离方程式为
的第二级电离方程式为(3)25℃时,
 与
与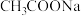 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中
,则溶液中
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I. 室温下,分别在2 mL ,0.1 mol/L HCl与0.1 mol/L CH3COOH溶液中投入足量镁条。
(1)反应前两溶液的pH:pH(盐酸)_______ pH(醋酸)(选填“>”、“<”或“=”,以下2空相同)。
(2)开始时与镁条反应的速率:v(盐酸)________ v(醋酸)。
(3)最终生成氢气的物质的量:盐酸________ 醋酸。
(4)反应前盐酸中c(OH-)=_________ mol/L。
II. 分别在2 mL氢离子浓度 均为0.1 mol/L的盐酸与醋酸溶液中投入足量的镁条。
(5)开始时与镁条反应的速率:v(盐酸)_____ v(醋酸)(选填““>”、“<”或“=”,以下2空相同)。
(6)两种酸起始的物质的量浓度:c(盐酸)______ c(醋酸)。
(7)最终生成氢气的的物质的量:盐酸______ 醋酸。
III. 已知次磷酸H3PO2是一元弱酸,20℃ 时的电离常数K ≈ 0.1。
(8)写出它的电离方程式______________________________ 。
(9)写出K的表达式:K=________ , 0℃ 时,0.2 mol/L H3PO2溶液的pH =_____ (平衡时c(H3PO2)不做近似处理)。
(1)反应前两溶液的pH:pH(盐酸)
(2)开始时与镁条反应的速率:v(盐酸)
(3)最终生成氢气的物质的量:盐酸
(4)反应前盐酸中c(OH-)=
II. 分别在2 mL
(5)开始时与镁条反应的速率:v(盐酸)
(6)两种酸起始的物质的量浓度:c(盐酸)
(7)最终生成氢气的的物质的量:盐酸
III. 已知次磷酸H3PO2是一元弱酸,20℃ 时的电离常数K ≈ 0.1。
(8)写出它的电离方程式
(9)写出K的表达式:K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Ⅰ.已知pOH也可以用来表示溶液的酸碱度,规定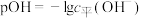 。不同温度下,水溶液中pOH与pH的关系如图所示。
。不同温度下,水溶液中pOH与pH的关系如图所示。

(1)t_______ 25(填“>”或“<”),图中A、B、C三点对应水的电离程度最大的是_______ 。
(2)25℃时,向100mL 0.005
 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液至
溶液至 恰好沉淀完全。
恰好沉淀完全。
①此过程中水的电离平衡_______ (填“正向”、“逆向”或“不”)移动。
②写出该过程发生反应的离子方程_______ ;若反应前后溶液体积的变化忽略不计,则反应后所得溶液的pH值为_______ (已知 )。
)。
(3)已知80℃时,水的离子积常数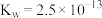 。该温度下,0.1
。该温度下,0.1 某一元酸(HA)溶液中
某一元酸(HA)溶液中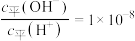 ,该溶液中由水电离的
,该溶液中由水电离的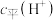 为
为_______ 。
Ⅱ.常温下,向20mL 0.2 某二元弱酸
某二元弱酸 溶液中滴加0.2
溶液中滴加0.2 NaOH溶液。有关粒子物质的量变化如图(其中Ⅰ代表
NaOH溶液。有关粒子物质的量变化如图(其中Ⅰ代表 ,Ⅱ代表
,Ⅱ代表 ,Ⅲ代表
,Ⅲ代表 )。
)。

(4)当V(NaOH溶液)=20mL时,溶液中离子浓度大小关系:_______ 。
(5)等体积等浓度的NaOH溶液与 溶液混合后,其溶液中水的电离程度比纯水
溶液混合后,其溶液中水的电离程度比纯水_______ (填“大”“小”或“相等”)。
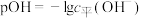 。不同温度下,水溶液中pOH与pH的关系如图所示。
。不同温度下,水溶液中pOH与pH的关系如图所示。
(1)t
(2)25℃时,向100mL 0.005

 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液至
溶液至 恰好沉淀完全。
恰好沉淀完全。①此过程中水的电离平衡
②写出该过程发生反应的离子方程
 )。
)。(3)已知80℃时,水的离子积常数
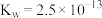 。该温度下,0.1
。该温度下,0.1 某一元酸(HA)溶液中
某一元酸(HA)溶液中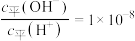 ,该溶液中由水电离的
,该溶液中由水电离的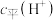 为
为Ⅱ.常温下,向20mL 0.2
 某二元弱酸
某二元弱酸 溶液中滴加0.2
溶液中滴加0.2 NaOH溶液。有关粒子物质的量变化如图(其中Ⅰ代表
NaOH溶液。有关粒子物质的量变化如图(其中Ⅰ代表 ,Ⅱ代表
,Ⅱ代表 ,Ⅲ代表
,Ⅲ代表 )。
)。
(4)当V(NaOH溶液)=20mL时,溶液中离子浓度大小关系:
(5)等体积等浓度的NaOH溶液与
 溶液混合后,其溶液中水的电离程度比纯水
溶液混合后,其溶液中水的电离程度比纯水
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
现将0.04mol∙L-1HA溶液和0.02mol∙L-1NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)_______ c(CN-) (填“<”、“=”或“>”)。
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是_______ 。
(2)常温下,向100mL0.01mol∙L-1HCl溶液中逐滴加入0.02mol∙L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
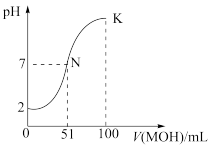
①常温下一定浓度的MCl稀溶液的pH_______ (填“>”“<”或“=”)7,用离子方程式表示其原因_______ 。
②K点对应的溶液中,c(M+)+c(MOH)_______ (填“>”“<”或“=”) 2c(Cl-)。
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
现将0.04mol∙L-1HA溶液和0.02mol∙L-1NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是
(2)常温下,向100mL0.01mol∙L-1HCl溶液中逐滴加入0.02mol∙L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

①常温下一定浓度的MCl稀溶液的pH
②K点对应的溶液中,c(M+)+c(MOH)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)在25℃ 时,某Na2SO4溶液中c(SO42-) = 5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) :c(OH-) = ___________ 。
(2)t℃ 时,水的离子积为1×10-12,将pH=11的NaOH溶液V1 L与pH=1的稀硫酸V2 L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1 :V2 =________ 。
(3)水电离生成H3O+ 和OH- 叫做水的自偶电离。同水一样,液氨也有自偶电离,其自偶电离的电离方程式为:________________________________ 。
(4)写出草酸溶液使酸性高锰酸钾溶液褪色的离子方程式______________________________ 。
(2)t℃ 时,水的离子积为1×10-12,将pH=11的NaOH溶液V1 L与pH=1的稀硫酸V2 L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1 :V2 =
(3)水电离生成H3O+ 和OH- 叫做水的自偶电离。同水一样,液氨也有自偶电离,其自偶电离的电离方程式为:
(4)写出草酸溶液使酸性高锰酸钾溶液褪色的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)已知25℃,H2C2O4的K1=5.0×10-2,K2=5.0×10-5。则NaHC2O4溶液显__________ (填“酸性”或“碱性”)。
(2)已知25℃,H2CO3的K1=4×10-7,K2=5×10-11。CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为__________ (写离子符号);若所得溶液中c(HCO3-):c(CO32-)=2:1,则溶液pH=__________ 。
(3)25℃时,V1L pH=11的NaOH溶液与V2L pH=3的H2SO4溶液混合,所得溶液的pH=10,则V1:V2=__________ (混合过程中溶液的体积变化忽略不计)。
(2)已知25℃,H2CO3的K1=4×10-7,K2=5×10-11。CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为
(3)25℃时,V1L pH=11的NaOH溶液与V2L pH=3的H2SO4溶液混合,所得溶液的pH=10,则V1:V2=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】盐类水解的类型和规律
(1)强碱弱酸盐水解,溶液呈___________ 性,pH___________ 7,如CH3COONa等。原因是___________ 与水电离出的___________ 结合生成___________ ,从而使溶液中c(H+)___________ ,c(OH-)___________ ,从而使c(OH-)___________ c(H+),溶液呈___________ 性。
(2)强酸弱碱盐水解,溶液呈___________ 性,pH___________ 7,如NH4Cl等。原因是___________ 与水电离出的___________ 结合生成___________ ,从而使溶液中c(H+)___________ ,c(OH-)___________ ,从而使c(OH-)___________ c(H+),溶液呈___________ 性。
(3)强酸强碱盐不发生水解,溶液呈___________ 性,pH___________ 7。
(1)强碱弱酸盐水解,溶液呈
(2)强酸弱碱盐水解,溶液呈
(3)强酸强碱盐不发生水解,溶液呈
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____ 。
②NaHSO3溶液中各离子浓度大小顺序:_____ 。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____ 。
②写出Na2CO3溶液中物料守恒表达式______ 。
③写出NaHCO3溶液中质子守恒表达式______ 。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____ (填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____ (填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____ ,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____ (填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____ 。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____ 。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
| 酸 | 电离常数 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式
②NaHSO3溶液中各离子浓度大小顺序:
(2)①用离子方程式表示Na2CO3溶液碱性的原因
②写出Na2CO3溶液中物料守恒表达式
③写出NaHCO3溶液中质子守恒表达式
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):
(6)证明CH3COOH是弱电解质的简单且可行的方法是:
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】化学物质在不同的领域发挥着重要的作用。根据要求回答下列问题:
(1)实验室需用Fe、C棒设计一套装置来电解饱和 溶液并检验两极生成的气体产物,则
溶液并检验两极生成的气体产物,则 棒应接直流电源的
棒应接直流电源的___________ (填“正极”或“负极”);电解开始后,阴极产物为___________ (填化学式)。
(2)将 溶液蒸干得到的物质是
溶液蒸干得到的物质是___________ ; 是一种液态化合物,遇水剧烈反应,产生白雾,同时生成能使品红溶液褪色的气体,其水解反应的化学方程式为
是一种液态化合物,遇水剧烈反应,产生白雾,同时生成能使品红溶液褪色的气体,其水解反应的化学方程式为___________ 。
(3)工业废水处理时向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中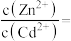
___________ 。[已知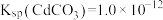 ,
,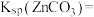
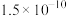 ]
]
(1)实验室需用Fe、C棒设计一套装置来电解饱和
 溶液并检验两极生成的气体产物,则
溶液并检验两极生成的气体产物,则 棒应接直流电源的
棒应接直流电源的(2)将
 溶液蒸干得到的物质是
溶液蒸干得到的物质是 是一种液态化合物,遇水剧烈反应,产生白雾,同时生成能使品红溶液褪色的气体,其水解反应的化学方程式为
是一种液态化合物,遇水剧烈反应,产生白雾,同时生成能使品红溶液褪色的气体,其水解反应的化学方程式为(3)工业废水处理时向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中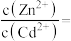
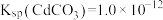 ,
,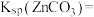
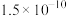 ]
]
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】25℃时,有关物质的电离平衡常数如下:
(1)三种酸由强至弱的顺序为 (用化学式表示)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为 。
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是 。
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是 。
A.c(CH3COO-)>c(HCO3-)>c(OH-)
B.c(Na+)+c(H+) = c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-)
D.c(CH3COO-)+c(CH3COOH) = c(HCO3-)+c(CO32-)
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)三种酸由强至弱的顺序为 (用化学式表示)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为 。
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是 。
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是 。
A.c(CH3COO-)>c(HCO3-)>c(OH-)
B.c(Na+)+c(H+) = c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-)
D.c(CH3COO-)+c(CH3COOH) = c(HCO3-)+c(CO32-)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】水溶液中的离子反应与平衡在生产和生活中有广泛的用途。回答下列问题:
(1)碳酸( )、次氯酸(HClO)的电离平衡常数如表:
)、次氯酸(HClO)的电离平衡常数如表:
将少量 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为_______ 。
(2)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L⁻¹ 溶液和40 mL 0.2 mol·L⁻¹
溶液和40 mL 0.2 mol·L⁻¹ 溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
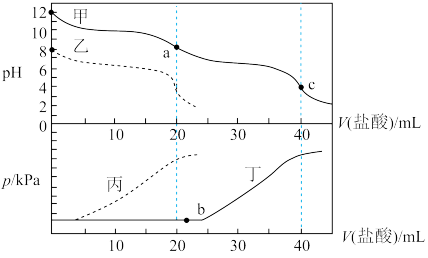
下列说法正确的是_______(填字母)。
(3)在25℃下,将a mol·L⁻¹的氨水与0.01 mol·L⁻¹的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离常数
的电离常数
_______ 。
(4)在一定温度下,用NaOH溶液将 转化为
转化为 溶液,实验测得
溶液,实验测得 溶液中
溶液中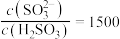 ,则该溶液的pH为
,则该溶液的pH为_______ (已知:该温度下 的
的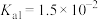 ,
, )。
)。
(1)碳酸(
 )、次氯酸(HClO)的电离平衡常数如表:
)、次氯酸(HClO)的电离平衡常数如表:| 弱酸 |  | HClO |
| 电离平衡常数(25℃) | 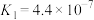  | 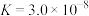 |
将少量
 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为(2)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L⁻¹
 溶液和40 mL 0.2 mol·L⁻¹
溶液和40 mL 0.2 mol·L⁻¹ 溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
下列说法正确的是_______(填字母)。
A. 溶液和 溶液和 溶液中微粒种类相同 溶液中微粒种类相同 |
B.图中曲线甲和丁表示向 溶液中滴加盐酸 溶液中滴加盐酸 |
C.在b点发生反应的离子方程式为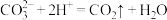 |
| D.滴定分析时,a点可用酚酞、c点可用甲基橙作指示剂指示滴定终点 |
 ,则溶液显
,则溶液显 的电离常数
的电离常数
(4)在一定温度下,用NaOH溶液将
 转化为
转化为 溶液,实验测得
溶液,实验测得 溶液中
溶液中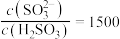 ,则该溶液的pH为
,则该溶液的pH为 的
的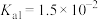 ,
, )。
)。
您最近一年使用:0次




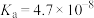


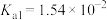

 ②
② ③
③ ④
④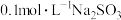 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)