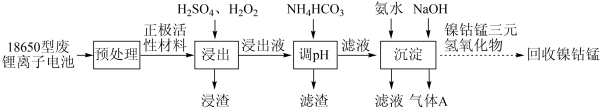
废三元锂离子电池中含有镍、钻、锰、锂、铝等金属元素,是重要的二次资源。由某18650型废三元锂离子电池回收镍、钻、锰的工艺流程如下图所示:
已知:①浸出液中各金属离子的质量浓度如下表。
② 能与
能与 、
、 、
、 形成配合物。
形成配合物。
Ⅰ.回答下列问题:
(1)“浸出”后得到浸出液的操作是___________ 。
(2)正极活性材料中的 在“浸出”过程中转化的化学方程式为
在“浸出”过程中转化的化学方程式为___________ 。
(3)镍、钴、锰的浸出率随时间、温度的变化如图1、图2所示。
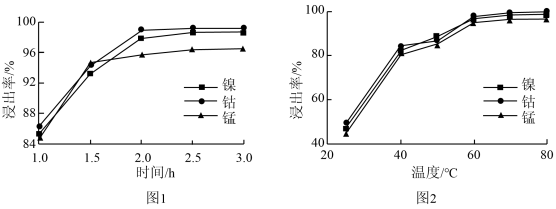
①综合考虑,选择浸出时间为___________ 。
②选择浸出温度范围为60-70℃,理由是___________ 。
(4)“调pH”中有沉淀生成,生成沉淀反应的离子方程式为___________ 。
(5)“沉淀”中气体A为___________ (填化学式)。沉淀后,分离获得镍钴锰三元氢氧化物沉淀并多次洗涤,判断沉淀洗净的方法是___________ 。
(6)已知25℃时,部分物质的溶度积常数如下:
要使滤液中 、
、 、
、 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全)的pH应大于
为沉淀完全)的pH应大于___________ ( ,
, )。
)。
Ⅱ.“氢能”是21世纪的绿色能源,研发新型储氢材料是开发利用氢能的重要研究方向。
(7) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
①基态 的未成对电子数有
的未成对电子数有___________ 个。
② 晶体由
晶体由 和
和 构成,
构成, 中B原子的杂化方式为
中B原子的杂化方式为___________ , 离子的空间构型为
离子的空间构型为___________ , 晶体含有的化学键有
晶体含有的化学键有___________ (填标号)。
A.离子键 B.极性键 C.非极性键 D配位键 E.金属键
(8)某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
M是___________ (填元素符号),判断理由为___________ 。
(9)镧镍合金也是一种重要储氢材料。某种镧镍合金储氢后的晶胞结构如图所示,其化学式为___________ 。


已知:①浸出液中各金属离子的质量浓度如下表。
| 金属离子 |  |  |  |  |  |
质量浓度( ) ) | 1600 | 5144 | 1495 | 842 | 254 |
 能与
能与 、
、 、
、 形成配合物。
形成配合物。Ⅰ.回答下列问题:
(1)“浸出”后得到浸出液的操作是
(2)正极活性材料中的
 在“浸出”过程中转化的化学方程式为
在“浸出”过程中转化的化学方程式为(3)镍、钴、锰的浸出率随时间、温度的变化如图1、图2所示。

①综合考虑,选择浸出时间为
②选择浸出温度范围为60-70℃,理由是
(4)“调pH”中有沉淀生成,生成沉淀反应的离子方程式为
(5)“沉淀”中气体A为
(6)已知25℃时,部分物质的溶度积常数如下:
| 物质 |  |  |  |
 | 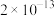 |  | 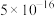 |
 、
、 、
、 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全)的pH应大于
为沉淀完全)的pH应大于 ,
, )。
)。Ⅱ.“氢能”是21世纪的绿色能源,研发新型储氢材料是开发利用氢能的重要研究方向。
(7)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①基态
 的未成对电子数有
的未成对电子数有②
 晶体由
晶体由 和
和 构成,
构成, 中B原子的杂化方式为
中B原子的杂化方式为 离子的空间构型为
离子的空间构型为 晶体含有的化学键有
晶体含有的化学键有A.离子键 B.极性键 C.非极性键 D配位键 E.金属键
(8)某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
 | 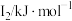 |  |  |  |
| 738 | 1451 | 7733 | 10540 | 13630 |
(9)镧镍合金也是一种重要储氢材料。某种镧镍合金储氢后的晶胞结构如图所示,其化学式为

更新时间:2023-10-26 08:11:47
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
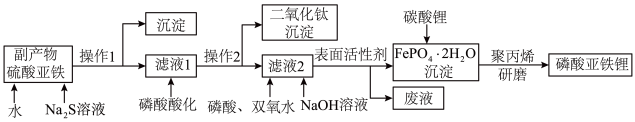
【推荐1】磷酸亚铁锂(LiFePO4)是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
常温下各种硫化物溶度积常数如下:
回答下列问题:
(1)为提高副产物硫酸亚铁浸取速率,除粉碎外,还可以采取的措施是_______ 。
(2)在滤液2中加入磷酸需控制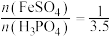 ,其目的是①提供较强的酸性环境;②
,其目的是①提供较强的酸性环境;②_______ ,聚丙烯的作用是_______ 。
(3)向滤液2中加入NaOH需控制溶液的pH≤2.2,其原因为_______ ;反应生成FePO4·2H2O的离子方程式为_______ 。
(4)已知当溶液中c(Mn+)≤10-5mol/L时视为沉淀完全,又知Ksp(FePO4)=1.32×10-22,Ksp[Fe(OH)3]=2.16×10-39,则要使滤液2中铁离子沉淀完全且不生成Fe(OH)3沉淀,应控制pH_______ 。[已知]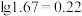 ,
,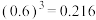 ]
]

常温下各种硫化物溶度积常数如下:
| 物质 | FeS | MnS | CuS | PbS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 1.6×10-24 |
回答下列问题:
(1)为提高副产物硫酸亚铁浸取速率,除粉碎外,还可以采取的措施是
(2)在滤液2中加入磷酸需控制
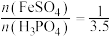 ,其目的是①提供较强的酸性环境;②
,其目的是①提供较强的酸性环境;②(3)向滤液2中加入NaOH需控制溶液的pH≤2.2,其原因为
(4)已知当溶液中c(Mn+)≤10-5mol/L时视为沉淀完全,又知Ksp(FePO4)=1.32×10-22,Ksp[Fe(OH)3]=2.16×10-39,则要使滤液2中铁离子沉淀完全且不生成Fe(OH)3沉淀,应控制pH
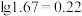 ,
,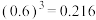 ]
]
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
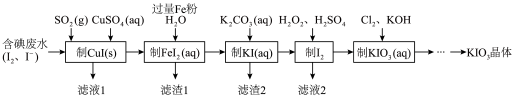
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________ 。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________ 。
(3)滤渣1的成分为________ 。
(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于________ 。
(5)“制KIO3溶液”时,发生反应的离子方程式为_______________________________ 。
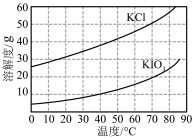
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为___________________ 。

(1)检验“含碘废水”中是否含有单质I2,常用的试剂是
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为
(3)滤渣1的成分为

(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于
(5)“制KIO3溶液”时,发生反应的离子方程式为
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________ 。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________ 。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
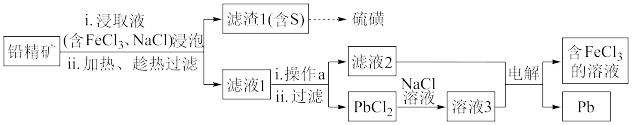
已知:①不同温度下PbCl2的溶解度如下表所示。
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq) PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________ 。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________ 。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于_______________ (填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________ 。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________ 。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:①不同温度下PbCl2的溶解度如下表所示。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
 PbCl42-(aq)
PbCl42-(aq) (3)浸取液中FeCl3的作用是
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于
②简述滤液2电解后再生为FeCl3的原理:
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E为原子序数依次增大的5种元素。A元素原子的价电子层中的未成对电子有3个;B元素原子的最外层电子数为其内层电子数的3倍;C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素原子最外层有1个未成对电子;E元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.请回答下列问题:
(1)D原子核外有_______ 种空间运动状态的电子,E元素基态原子的价层电子轨道示意图为_______ 。
(2)元素B有两种同素异形体,其中沸点高的是_______ (填分子式),原因是_______ 。
(3)A、B、C中第一电离能最大的是_______ (填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是_______ 。
(4)化合物 的立体构型为
的立体构型为_______ ,单质D与湿润的 反应可制备
反应可制备 ,其化学方程式为
,其化学方程式为_______ 。
(5)E与C所形成化合物晶体的晶胞如图所示。
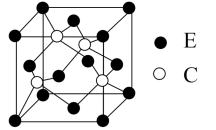
①在1个晶胞中,E离子的数目为_______ 。
②该化合物的化学式为_______ 。
(1)D原子核外有
(2)元素B有两种同素异形体,其中沸点高的是
(3)A、B、C中第一电离能最大的是
(4)化合物
 的立体构型为
的立体构型为 反应可制备
反应可制备 ,其化学方程式为
,其化学方程式为(5)E与C所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,E离子的数目为
②该化合物的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】请回答:
(1)下列状态的钙中,电离最外层的一个电子所需能量最大的是__________ 。
A.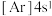 B.
B.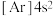 C.
C.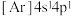 D.
D.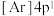
 和
和 的半径比较:
的半径比较: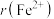
__________ 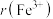 [填“
[填“ ”、“
”、“ ”或“
”或“ ”,下同]。
”,下同]。 和
和 的键角比较
的键角比较
________  。
。
(2)常温下, 苯和
苯和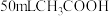 混合,溶液的总体积大于
混合,溶液的总体积大于 ,理由是
,理由是___________ 。 熔点为
熔点为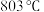 ,而等物质的量的
,而等物质的量的 和
和 组成的混合体系的熔点却只有
组成的混合体系的熔点却只有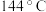 ,解析原因
,解析原因__________ 。
(3)某晶体的晶胞在 平面上的投影图如下(A为K、B为Fe、C为Se):则该晶体的化学式为
平面上的投影图如下(A为K、B为Fe、C为Se):则该晶体的化学式为___________ 。

(1)下列状态的钙中,电离最外层的一个电子所需能量最大的是
A.
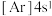 B.
B.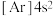 C.
C.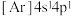 D.
D.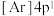
 和
和 的半径比较:
的半径比较: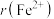
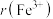 [填“
[填“ ”、“
”、“ ”或“
”或“ ”,下同]。
”,下同]。 和
和 的键角比较
的键角比较
 。
。(2)常温下,
 苯和
苯和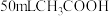 混合,溶液的总体积大于
混合,溶液的总体积大于 ,理由是
,理由是 熔点为
熔点为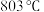 ,而等物质的量的
,而等物质的量的 和
和 组成的混合体系的熔点却只有
组成的混合体系的熔点却只有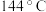 ,解析原因
,解析原因(3)某晶体的晶胞在
 平面上的投影图如下(A为K、B为Fe、C为Se):则该晶体的化学式为
平面上的投影图如下(A为K、B为Fe、C为Se):则该晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)氮原子核外有_______ 种不同运动状态的电子。
(2)铵盐大多不稳定。请判断NH4F、NH4I中,谁较易分解并说明理由:_______ 。
(3)经测定发现,N2O5固体由NO 和
和 两种离子组成,该固体中氮原子杂化类型为
两种离子组成,该固体中氮原子杂化类型为_____ 。
(4)第2周期中,第一电离能介于硼元素和氮元素间的元素为_______ (填元素符号)。
(5)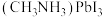 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
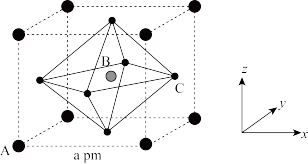
①原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),则C的原子分数坐标为_______ 。
②该晶胞沿体对角线方向的投影图为_______ (填标号)。
a.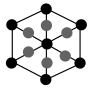 b.
b. 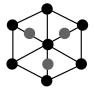 c.
c.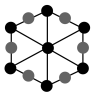 d.
d.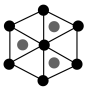
(6)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______ 个硼原子构成。

(7)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,硼、氮原子相互交替排列(见图II),其晶胞结构如图III所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为_______ g/cm3(用含a、b、NA的代数式表示)。
(1)氮原子核外有
(2)铵盐大多不稳定。请判断NH4F、NH4I中,谁较易分解并说明理由:
(3)经测定发现,N2O5固体由NO
 和
和 两种离子组成,该固体中氮原子杂化类型为
两种离子组成,该固体中氮原子杂化类型为(4)第2周期中,第一电离能介于硼元素和氮元素间的元素为
(5)
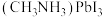 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
①原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),则C的原子分数坐标为
②该晶胞沿体对角线方向的投影图为
a.
 b.
b.  c.
c. d.
d.
(6)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由

(7)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,硼、氮原子相互交替排列(见图II),其晶胞结构如图III所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】硫、硒及其化合物在科研和工农业生产中有着广泛应用。请回答:
(1)Se与S同主族, 分子的VSEPR模型为
分子的VSEPR模型为___________ , 的沸点高于
的沸点高于 的原因是
的原因是___________ 。
(2)基态硒原子的价电子排布式为___________ ,Se的第一电离能比同周期相邻元素As小的原因是___________ 。
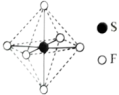
(3) 可用作高压发电系统的绝缘气体,分子结构如图1所示,下列说法正确的是___________。
可用作高压发电系统的绝缘气体,分子结构如图1所示,下列说法正确的是___________。
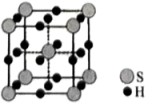
(4)单质硫和氢气在低温高压下可形成一种新型的超导材料,其晶胞结构如图,该化合物的化学式为___________ 。
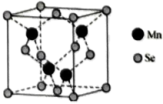
(5)已知β-MnSe晶体的晶胞结构如图所示,该正方体晶胞的边长为a pm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出表达式)。
(列出表达式)。
(1)Se与S同主族,
 分子的VSEPR模型为
分子的VSEPR模型为 的沸点高于
的沸点高于 的原因是
的原因是(2)基态硒原子的价电子排布式为
(3)
 可用作高压发电系统的绝缘气体,分子结构如图1所示,下列说法正确的是___________。
可用作高压发电系统的绝缘气体,分子结构如图1所示,下列说法正确的是___________。
| A.该分子属于非极性分子 |
| B.电负性F>S,键角∠FSF为90°或180° |
C.中心原子的杂化方式为 |
D.该分子中所有原子均满足8 的稳定结构 的稳定结构 |

(5)已知β-MnSe晶体的晶胞结构如图所示,该正方体晶胞的边长为a pm,阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
(1)写出A、C、E三种元素的符号:
A_________ , C___________ , E__________ 。
(2) 甲、乙两分子中含有非极性共价键的是____________ (填分子式),它的电子式为_____________ 。
(3)C、D、F的离子中,半径最小的是______ (填离子符号)
(4)在化合物BA4中元素B的杂化方式为:_______ 杂化,BA4的空间构型___ 。
(5)用氢键表示式写出液态D的氢化物中存在的氢键______________ 。
(1)写出A、C、E三种元素的符号:
A
(2) 甲、乙两分子中含有非极性共价键的是
(3)C、D、F的离子中,半径最小的是

(4)在化合物BA4中元素B的杂化方式为:
(5)用氢键表示式写出液态D的氢化物中存在的氢键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为__________ 。铁、钴、镍的基态原子核外未成对电子数最多的是________ 。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的 [Co(NH3)6]Cl3晶体。该配合物中中心离子是_________ ,配体分子的价层电子对互斥模型________ 。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253 K,沸点为376 K,则Ni(CO)4固体属于晶体____________ ,1mol Ni(CO)4含有的配位键数目为_______ 。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO__________ FeO(填“>”“<”或“=”),原因是_____________ 。
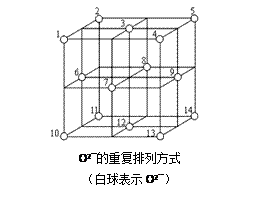
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为___________ ,有___________ %的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18 g/cm3,则该晶胞参数a = _______________ pm。(写出计算表达式)
(1)基态铁原子的价电子排布式为
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的 [Co(NH3)6]Cl3晶体。该配合物中中心离子是
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253 K,沸点为376 K,则Ni(CO)4固体属于晶体
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________ ,能量最高的电子所处的能层的符号为_________ 。
(2)SO42-空间构型为__________ ,中心原子的轨道杂化方式是________ ,写出一个与SO42-互为等电子体的分子的化学式__________ 。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________ 。
(4)O、N、S的第一电离能从大到小的顺序是___________________ 。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________ 。
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________ 。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________ 。

(1)基态S原子的价电子排布式为
(2)SO42-空间构型为
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:
(4)O、N、S的第一电离能从大到小的顺序是
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:
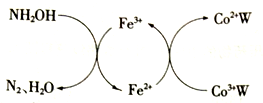
(1)Co2+基态核外电子排布式为________ 。
(2)NH2OH分子中氮原子轨道的杂化类型是_______ ,lmolNH2OH分子中含有σ键的数目为_______ 。
(3)N、H、O三种元素的电负性由小到大的顺序为_________ 。
(4)ClO4-的空间构型为__________ 。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________ 。


(1)Co2+基态核外电子排布式为
(2)NH2OH分子中氮原子轨道的杂化类型是
(3)N、H、O三种元素的电负性由小到大的顺序为
(4)ClO4-的空间构型为
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。
(1)以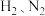 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_______ 。
②实际生产中采用铁的氧化物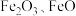 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
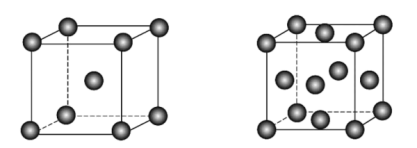
两种晶胞所含铁原子个数比为_______ 。
③我国科学家开发出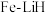 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能(I1):
中显示出高催化活性。第一电离能(I1):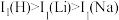 ,从原子结构角度解释原因是
,从原子结构角度解释原因是_______ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。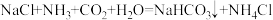
①1体积水可溶解1体积 ,1体积水可溶解约700体积
,1体积水可溶解约700体积 。
。 极易溶于水的原因是
极易溶于水的原因是_______ 。
② 分解
分解 。
。 空间结构为
空间结构为_______ 。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。(1)以
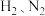 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。①基态Fe原子的电子排布式为
②实际生产中采用铁的氧化物
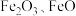 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
两种晶胞所含铁原子个数比为
③我国科学家开发出
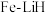 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能(I1):
中显示出高催化活性。第一电离能(I1):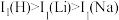 ,从原子结构角度解释原因是
,从原子结构角度解释原因是(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
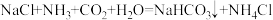
①1体积水可溶解1体积
 ,1体积水可溶解约700体积
,1体积水可溶解约700体积 。
。 极易溶于水的原因是
极易溶于水的原因是②
 分解
分解 。
。 空间结构为
空间结构为
您最近一年使用:0次



