用甲烷制高纯氢气是目前研究热点之一。
(1)一定条件下, 反应历程如图1所示,其中化学反应速率最慢的反应过程为
反应历程如图1所示,其中化学反应速率最慢的反应过程为______________ 。

①总反应: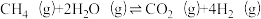 △H=
△H=______________ 。
②已知830℃时,反应Ⅱ的平衡常数K=1。在容积不变的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为______________ 。
③在常压、600℃条件下,甲烷制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后,H2的产率可提高到95%,应用化学平衡移动原理解释原因______________ 。
(3)科学家研究将CH4、H2O与CH4、CO2联合重整制备氢气:

常压下,将CH4、H2O和CO2按一定比例混合置于密闭容器中,相同时间不同温度下测得体系中n(H2):n(CO)变化如图2所示。_____________ H2(填“>”“<”或“=”)。
②随着温度升高n(H2):(CO)变小的原因可能是_________________ 。
(1)一定条件下,
 反应历程如图1所示,其中化学反应速率最慢的反应过程为
反应历程如图1所示,其中化学反应速率最慢的反应过程为

①总反应:
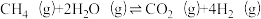 △H=
△H=②已知830℃时,反应Ⅱ的平衡常数K=1。在容积不变的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为
③在常压、600℃条件下,甲烷制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后,H2的产率可提高到95%,应用化学平衡移动原理解释原因
(3)科学家研究将CH4、H2O与CH4、CO2联合重整制备氢气:

常压下,将CH4、H2O和CO2按一定比例混合置于密闭容器中,相同时间不同温度下测得体系中n(H2):n(CO)变化如图2所示。

②随着温度升高n(H2):(CO)变小的原因可能是
更新时间:2023-12-04 17:32:19
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图a所示。在通常状况下,金刚石和石墨中,__________ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__________ 。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式__________________________________________ 。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g) CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
则:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l) △H=
CH3CH2OH(g)+3H2O(l) △H=___________________ 。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对上述流程的分析,下列说法正确的是_________ 。

A.该流程至少包含4种形式的能量转化
B.装置X中阴极反应为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图b为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

① E为该燃料电池的___________ 极(填“正”或“负”)。F电极上的电极反应式为___________ 。
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因__________________________ 。
(1)金刚石和石墨燃烧反应中的能量变化如图a所示。在通常状况下,金刚石和石墨中,

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式
(3)CO2为原料还可合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-12CO(g)+4H2 (g)
 CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1则:2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(l) △H=
CH3CH2OH(g)+3H2O(l) △H=②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对上述流程的分析,下列说法正确的是

A.该流程至少包含4种形式的能量转化
B.装置X中阴极反应为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图b为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

① E为该燃料电池的
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种应用前景广泛的新材料,实验室中可用甲醇、CO、CO2等进行合成。回答下列问题:
(1)二氧化碳的电子式为_________________
(2)用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。
已知:①CO的标准燃烧热为:−283.0kJ•mol−1,
则2CH3OH(g)+CO(g)+1/2O2(g)⇌CH3OCOOCH3 (g)+H2O(l)△H=_____ 。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________ 。
(3)由上述反应可知甲醇和CO2可直接合成DMC但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
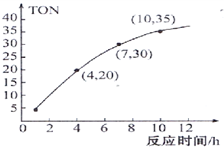
在该温度下,最佳反应时间是_________ h;4~10h内DMC的平均反应速率是_______ .
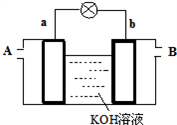
(4)以多孔铂为电极,在如下图装置中A、B口分别通入CH3OCOOCH3和O2构成燃料电池,请写出该电池负极的电极反应式____________________________
(1)二氧化碳的电子式为
(2)用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。
已知:①CO的标准燃烧热为:−283.0kJ•mol−1,
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
③2CH3OH(g)+CO2(g)⇌CH3OCOOCH3(g)+H2O(g)△H=−15.5kJ•mol−1
则2CH3OH(g)+CO(g)+1/2O2(g)⇌CH3OCOOCH3 (g)+H2O(l)△H=
该反应在常压和70~120℃条件下就能自发反应的原因是
(3)由上述反应可知甲醇和CO2可直接合成DMC但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
①写出该反应平衡常数表达式:
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是
A.v正(CH3OH)=2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10−5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图1所示.(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。

在该温度下,最佳反应时间是
(4)以多孔铂为电极,在如下图装置中A、B口分别通入CH3OCOOCH3和O2构成燃料电池,请写出该电池负极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g) CH3OH(g)ΔH=-90.8kJ/mol
CH3OH(g)ΔH=-90.8kJ/mol
反应②:H2(g)+CO2(g) H2O(g)+CO(g)ΔH=+41.2kJ/mol
H2O(g)+CO(g)ΔH=+41.2kJ/mol
(1)写出用CO2与H2反应制备甲醇的热化学方程式___ 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
由以上数据可知,该反应的ΔH___ 0(填“>”或“<”)。500℃时,CO和H2O的起始浓度均为0.020mol/L,该条件下CO的平衡浓度为:___ mol/L。

(3) 一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,某温度下发生上述反应,氢气的浓度随时间变化如图,若在20min时减小压强,并在30min时达到平衡状态,请在图中画出H2的物质的量浓度随时间变化的图象___ 。
(4)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极区间允许K+通过的半透膜隔开。

①该燃料电池负极电极反应式为___ 。
②放电过程中需补充的物质A为___ (填化学式)。
反应①:2H2(g)+CO(g)
 CH3OH(g)ΔH=-90.8kJ/mol
CH3OH(g)ΔH=-90.8kJ/mol反应②:H2(g)+CO2(g)
 H2O(g)+CO(g)ΔH=+41.2kJ/mol
H2O(g)+CO(g)ΔH=+41.2kJ/mol(1)写出用CO2与H2反应制备甲醇的热化学方程式
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
由以上数据可知,该反应的ΔH

(3) 一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,某温度下发生上述反应,氢气的浓度随时间变化如图,若在20min时减小压强,并在30min时达到平衡状态,请在图中画出H2的物质的量浓度随时间变化的图象
(4)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极区间允许K+通过的半透膜隔开。

①该燃料电池负极电极反应式为
②放电过程中需补充的物质A为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】苯乙烯是重要的有机化工原料,可用乙苯为原料制备苯乙烯。常见的方法有直接脱氢法和氧化脱氢法。反应原理表示如下:
反应①(氧化脱氢):
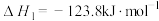
反应②(直接脱氢):
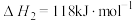
(1)H2的燃烧反应: 的焓变
的焓变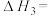
__________  。
。
(2)判断反应①能否自发进行,并说明理由。______________
(3)欲提高反应①中乙苯平衡转化率,可采用的措施有_____________ 、_____________ 。
(4)某温度下,向2L容器中通入2mol气态乙苯与2mol O2发生反应①,10min后反应达到平衡,此时混合气体中乙苯和苯乙烯的物质的量相等。
①可以判断反应①达到化学平衡状态的标志是_____________
A.正反应与逆反应不再进行 B.气体密度不再改变
C.体系压强不再改变 D.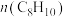 与
与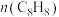 之和保持不变
之和保持不变
②从开始反应至达到平衡时间段内平均反应速率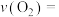
_____________ 。
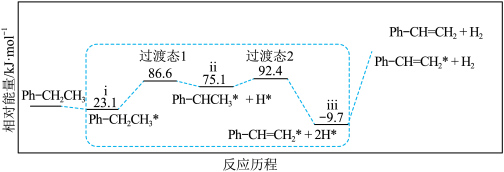
(5)中国化学家提出了在某催化剂表面反应②的机理(Ph-代表苯基,*代表吸附态):___________ 步反应。
A.1 B.2 C.3 D.4
②虚线框内化学反应速率最慢的一步活化能的值为_____________ kJ·mol-1。
A.11.5 B.17.3 C.63.5 D.102.1
③关于上述反应历程说法正确的是___________ (不定项)。
A.物质吸附在催化剂表面时通常比其形成的过渡态稳定
B.使用催化剂后,有效提升了乙苯的平衡转化率
C.状态ⅱ→状态ⅲ过程中形成了π键
D.状态ⅲ→状态ⅳ的能量变化说明形成H-H键是吸热过程
④若工业上采用反应②来生产苯乙烯,常伴有乙苯的裂解副反应,且一般情况下,该副反应的反应速率与程度都比反应②大。生产中可____________ (填措施名称)来提高反应②的选择性。
反应①(氧化脱氢):

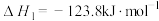
反应②(直接脱氢):

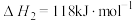
(1)H2的燃烧反应:
 的焓变
的焓变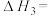
 。
。(2)判断反应①能否自发进行,并说明理由。
(3)欲提高反应①中乙苯平衡转化率,可采用的措施有
(4)某温度下,向2L容器中通入2mol气态乙苯与2mol O2发生反应①,10min后反应达到平衡,此时混合气体中乙苯和苯乙烯的物质的量相等。
①可以判断反应①达到化学平衡状态的标志是
A.正反应与逆反应不再进行 B.气体密度不再改变
C.体系压强不再改变 D.
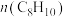 与
与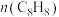 之和保持不变
之和保持不变②从开始反应至达到平衡时间段内平均反应速率
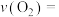
(5)中国化学家提出了在某催化剂表面反应②的机理(Ph-代表苯基,*代表吸附态):
A.1 B.2 C.3 D.4
②虚线框内化学反应速率最慢的一步活化能的值为
A.11.5 B.17.3 C.63.5 D.102.1
③关于上述反应历程说法正确的是
A.物质吸附在催化剂表面时通常比其形成的过渡态稳定
B.使用催化剂后,有效提升了乙苯的平衡转化率
C.状态ⅱ→状态ⅲ过程中形成了π键
D.状态ⅲ→状态ⅳ的能量变化说明形成H-H键是吸热过程
④若工业上采用反应②来生产苯乙烯,常伴有乙苯的裂解副反应,且一般情况下,该副反应的反应速率与程度都比反应②大。生产中可
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮氧化物(NOx)造成酸雨、光化学烟雾、臭氧层破坏等危害,不仅破坏自然生态环境,而且严重危害人类健康。采用合适的还原剂能够实现烟气的高效脱硝。
(1)活性炭还原脱硝可防止氮氧化物污染,已知:
①N2(g)+O2(g)═2NO(g) △H1=+180.5kJ•mol-1
②2C(s)+O2(g)═2CO(g) △H2=-221.0kJ•mol-1
③2CO(g)+O2(g)═2CO2(g) △H3=-556.0kJ•mol-1
则反应C(s)+2NO(g) N2(g)+CO2(g)△H=
N2(g)+CO2(g)△H=__ kJ•mol-1
(2)用活性炭对NO进行还原,采用相同质量不同粒径的同种催化剂M和N,测量相同时间内烟气的脱氮率,结果如图所示。
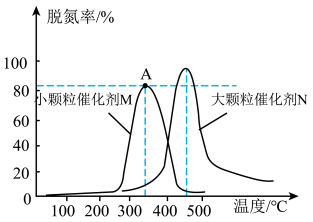
①在M、N两种不同粒径催化剂作用下,出现M和N两条不同的脱氮率与温度的变化曲线的原因是___ 。
②判断M曲线上最高点A点对应的脱氮率__ (填“是“或“不是”)该温度下的平衡脱氮率。
③25℃下,用NaOH溶液作捕捉剂吸收产生的CO2,不仅可以降低碳排放,而且可得到重要的化工产品。某次捕捉后得到pH=12的溶液,已知:25℃下Ka2(H2CO3)=5.6×10-11,试通过计算溶液中c(CO32-):c(HCO3-)=__ 。
(3)在一恒容密闭容器中,使用某种催化剂对反应NO2(g)+SO2(g) SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。
SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。
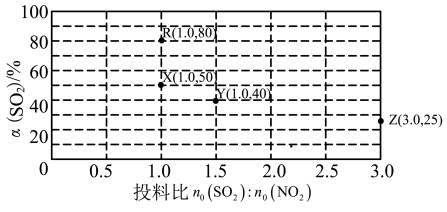
①如果要将图中R点的平衡状态改变为X点的平衡状态,应采取的措施是__ 。
②图中R、X、Y、Z四点对应的实验温度分别为TR、TX、TY,TZ通过计算选择下列选项中两个温度相等是__ (填标号)。
A.TR和TY B.TR和TZ C.TX和TZ D.TY和TZ
(1)活性炭还原脱硝可防止氮氧化物污染,已知:
①N2(g)+O2(g)═2NO(g) △H1=+180.5kJ•mol-1
②2C(s)+O2(g)═2CO(g) △H2=-221.0kJ•mol-1
③2CO(g)+O2(g)═2CO2(g) △H3=-556.0kJ•mol-1
则反应C(s)+2NO(g)
 N2(g)+CO2(g)△H=
N2(g)+CO2(g)△H=(2)用活性炭对NO进行还原,采用相同质量不同粒径的同种催化剂M和N,测量相同时间内烟气的脱氮率,结果如图所示。

①在M、N两种不同粒径催化剂作用下,出现M和N两条不同的脱氮率与温度的变化曲线的原因是
②判断M曲线上最高点A点对应的脱氮率
③25℃下,用NaOH溶液作捕捉剂吸收产生的CO2,不仅可以降低碳排放,而且可得到重要的化工产品。某次捕捉后得到pH=12的溶液,已知:25℃下Ka2(H2CO3)=5.6×10-11,试通过计算溶液中c(CO32-):c(HCO3-)=
(3)在一恒容密闭容器中,使用某种催化剂对反应NO2(g)+SO2(g)
 SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。
SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。
①如果要将图中R点的平衡状态改变为X点的平衡状态,应采取的措施是
②图中R、X、Y、Z四点对应的实验温度分别为TR、TX、TY,TZ通过计算选择下列选项中两个温度相等是
A.TR和TY B.TR和TZ C.TX和TZ D.TY和TZ
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】合成氨是人类科学技术上的一项重大突破,工业合成氨的简式流程图如下
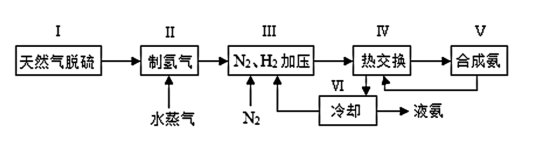
(1)天然气中的H2S杂质常用氨水吸收,写出足量的H2S与氨水反应的化学方程式:__ 。
(2)步骤II中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为___ 。
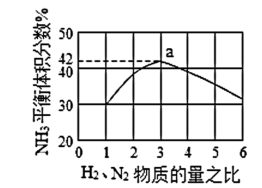
(3)下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数__ 。
(4)依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气 开始,随温度不断升高,NH3物质的量变化的曲线示意图______ 。
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是_ (填序号)。简述本流程中提高合成氨原料总转化率的方法__ 。

(1)天然气中的H2S杂质常用氨水吸收,写出足量的H2S与氨水反应的化学方程式:
(2)步骤II中制氢气的原理如下:
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为
(3)下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数

(4)依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从

(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。已知:达平衡后,若其他条件不变将容器体积缩小至原来一半,其气体平均摩尔质量不变。
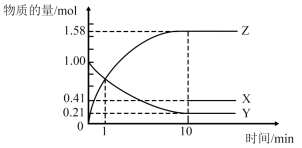
(1)该反应的化学方程式可表示为_______ ;
(2)下列条件的改变能减慢其反应速率的是_______ (填序号)。
①降低温度 ②增加X的物质的量
③保持压强不变,充入He使容器的体积增大 ④保持容积不变,充入He使体系压强增大
Ⅱ.碳中和作为一种新型环保形式可推动全社会绿色发展。复合催化是工业合成甲醇(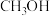 ,沸点64.7℃)的重要反应。在2L密闭容器中,充入10mol
,沸点64.7℃)的重要反应。在2L密闭容器中,充入10mol  和40mol
和40mol  ,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:
,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:
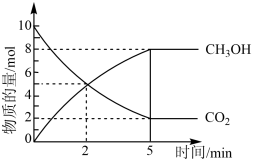
(3)反应开始至2min末,以 的浓度变化表示该反应的平均速率
的浓度变化表示该反应的平均速率_______ 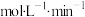 。
。
(4)下列情况不能说明该反应达到化学平衡状态的是_______(填字母)。
Ⅲ.某校化学兴趣小组对 、
、 进行了深入的研究。
进行了深入的研究。
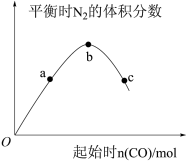
(5)该兴趣小组同学对反应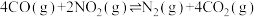 进行了研究,保持其他条件不变,改变CO的物质的量,平衡时
进行了研究,保持其他条件不变,改变CO的物质的量,平衡时 的体积分数变化情况如图所示。平衡时
的体积分数变化情况如图所示。平衡时 的体积分数a、b、c三点
的体积分数a、b、c三点 转化率由小到大的顺序为
转化率由小到大的顺序为_______ ;b点时的投料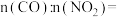
_______ 。
(6)向恒容密闭容器中通入一定量 ,发生反应
,发生反应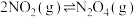 ,达到平衡后,降低温度,混合气体颜色变浅。
,达到平衡后,降低温度,混合气体颜色变浅。
①若需要测定 的相对分子质量,为了测定更准确,则需要的外界条件为
的相对分子质量,为了测定更准确,则需要的外界条件为_______ 。
②该反应达到平衡时,向恒容密闭容器中通入一定量 ,则再次达到平衡时,
,则再次达到平衡时, 的物质的量分数将
的物质的量分数将_______ (填“升高”“不变”“降低”)。

(1)该反应的化学方程式可表示为
(2)下列条件的改变能减慢其反应速率的是
①降低温度 ②增加X的物质的量
③保持压强不变,充入He使容器的体积增大 ④保持容积不变,充入He使体系压强增大
Ⅱ.碳中和作为一种新型环保形式可推动全社会绿色发展。复合催化是工业合成甲醇(
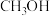 ,沸点64.7℃)的重要反应。在2L密闭容器中,充入10mol
,沸点64.7℃)的重要反应。在2L密闭容器中,充入10mol  和40mol
和40mol  ,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:
,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:
(3)反应开始至2min末,以
 的浓度变化表示该反应的平均速率
的浓度变化表示该反应的平均速率 。
。(4)下列情况不能说明该反应达到化学平衡状态的是_______(填字母)。
A.单位时间内消耗1mol  ,同时生成1mol ,同时生成1mol 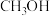 |
B. 的物质的量保持不变 的物质的量保持不变 |
C.密闭容器中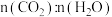 不发生变化时 不发生变化时 |
| D.密闭容器内气体压强不发生变化时 |
Ⅲ.某校化学兴趣小组对
 、
、 进行了深入的研究。
进行了深入的研究。(5)该兴趣小组同学对反应
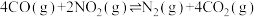 进行了研究,保持其他条件不变,改变CO的物质的量,平衡时
进行了研究,保持其他条件不变,改变CO的物质的量,平衡时 的体积分数变化情况如图所示。平衡时
的体积分数变化情况如图所示。平衡时 的体积分数a、b、c三点
的体积分数a、b、c三点 转化率由小到大的顺序为
转化率由小到大的顺序为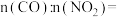

(6)向恒容密闭容器中通入一定量
 ,发生反应
,发生反应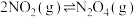 ,达到平衡后,降低温度,混合气体颜色变浅。
,达到平衡后,降低温度,混合气体颜色变浅。①若需要测定
 的相对分子质量,为了测定更准确,则需要的外界条件为
的相对分子质量,为了测定更准确,则需要的外界条件为②该反应达到平衡时,向恒容密闭容器中通入一定量
 ,则再次达到平衡时,
,则再次达到平衡时, 的物质的量分数将
的物质的量分数将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】“霾”是当今世界环境热点话题。目前各地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
在一定温度下,将2.0 molNO、2.4 mol CO气体通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
① 0〜15 min NO的转化率为_________ 。
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________ (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将________ (选填“向左”,“向右”或“不”)移动,重新达到平衡后,该反应的化学平衡数为_______________ 。
(2)已知: 2NO(g)+O2(g) =2NO2(g) △H=-bkJ·mol-1(b>0) ; CO的燃烧热 △H=-ckJ·mol-1(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式________ 。
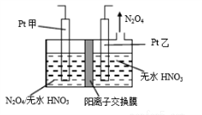
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为_____ 极,电解池中生成N2O5的电极反应式是__________________ 。
2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)在一定温度下,将2.0 molNO、2.4 mol CO气体通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
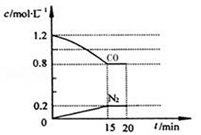
① 0〜15 min NO的转化率为
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将
(2)已知: 2NO(g)+O2(g) =2NO2(g) △H=-bkJ·mol-1(b>0) ; CO的燃烧热 △H=-ckJ·mol-1(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,以气体Z表示的平均反应速率为___________ 。
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时___________  填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同 ,混合气体密度比起始时
,混合气体密度比起始时___________ 。
(4)下列叙述能证明该反应已经达到化学平衡状态的是 填序号
填序号 ___________。
___________。
(5)若X、Y、Z分别H2(g)、N2(g)、NH3(g),反应条件是高温、高压,并且需要合适的催化剂。已知形成1molH—H键、1molN—H键、1molN≡N键放出的能量分别为436kJ、391kJ、946kJ。则1mol氮气完全反应生成氨气理论上可放出的能量为___________ kJ。

(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时
 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同 ,混合气体密度比起始时
,混合气体密度比起始时(4)下列叙述能证明该反应已经达到化学平衡状态的是
 填序号
填序号 ___________。
___________。| A.Y的体积分数不再变化 |
| B.容器内气体压强不再变化 |
| C.υ(X):υ(Y)=3:1 |
| D.单位时间内消耗3nmolX同时生成2nmolZ |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】“绿水青山就是金山银山”,研究NOx、SO2等大气污染物的妥善处理具有重要意义。
CO还原NO的脱硝反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g)△H
(1)已知:CO(g)+NO2(g)⇌CO2(g)+NO(g)△H1=-226 kJ·mol-1
N2(g)+2O2(g)⇌2NO2(g)△H2=+68 kJ·mol-1
N2(g)+O2(g)⇌2NO(g)△H3=+183 kJ·mol-1
脱硝反应△H=__________ ,有利于提高NO平衡转化率的条件是________________ (写出两条)。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~10min内,平均反应速率v(CO2)=___ mol·L-1·min-1。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________ (填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气。
有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为______________ 。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数________ (填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则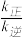 =
=________ (计算结果用分数表示)
CO还原NO的脱硝反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g)△H
(1)已知:CO(g)+NO2(g)⇌CO2(g)+NO(g)△H1=-226 kJ·mol-1
N2(g)+2O2(g)⇌2NO2(g)△H2=+68 kJ·mol-1
N2(g)+O2(g)⇌2NO(g)△H3=+183 kJ·mol-1
脱硝反应△H=
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)
 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:| 时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气。
有人利用反应C(s)+2NO(g)
 N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,仅降低温度,k正减小的倍数
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则
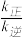 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】合成氨是人类科技发展史上的一项重大突破。
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 molNH3(g),放出9.24kJ的热量。在下图中画出合成氨反应中用焓(H)变表示反应热的示意图________ 。

(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为______________ mol/(L.min)。
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是______________ (写出一条)。
(4)下图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是______________ 。

a.图中a点,容器内n(N2):n(NH3)=1:4
b.图中b点,v正<v逆
c.400~530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 molNH3(g),放出9.24kJ的热量。在下图中画出合成氨反应中用焓(H)变表示反应热的示意图

(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是
(4)下图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是

a.图中a点,容器内n(N2):n(NH3)=1:4
b.图中b点,v正<v逆
c.400~530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】反应2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-746.8kJ•mol-1,常用于处理汽车尾气,实验表明,高于120℃且无催化剂时,该反应分三步完成,前两步如下:
2CO2(g)+N2(g) △H=-746.8kJ•mol-1,常用于处理汽车尾气,实验表明,高于120℃且无催化剂时,该反应分三步完成,前两步如下:
第1步:2NO(g) N2O2(g) △H=-103kJ•mol-1
N2O2(g) △H=-103kJ•mol-1
第2步:N2O2(g)+CO(g) N2O(g)+CO2(g) △H=-293.5kJ•mol-1
N2O(g)+CO2(g) △H=-293.5kJ•mol-1
(1)写出第3步反应的热化学方程式_____ 。
(2)三步反应中,第2、3步是快反应,第1步是慢反应,请分析决定反应速率的是第_____ 步。
(3)560℃时,向2L恒容密闭容器中充入2molCO和2molNO,反应10min后达到平衡状态,压力传感器测得压强为反应前的76.25%。
①写出总反应2CO(g)+2NO(g) 2CO2(g)+N2(g)平衡常数的表达式K=
2CO2(g)+N2(g)平衡常数的表达式K=_____ 。
②用N2的浓度变化表示该反应的平均反应速率v(N2)=_____ (写出计算过程)。
(4)高于120℃且无催化剂时,总反应速率v=k•(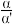 -1)1.2(1-nα′),α是平衡转化率;α′是瞬时转化率;k是速率常数,只受温度影响,温度升高,速率常数增大;n为常数,且nα′<1。
-1)1.2(1-nα′),α是平衡转化率;α′是瞬时转化率;k是速率常数,只受温度影响,温度升高,速率常数增大;n为常数,且nα′<1。
①恒温密闭容器中充入CO和NO发生总反应,请画出总反应速率(v)随瞬时转化率(α′)的变化曲线图α′<α)_____ 。

②实验表明:高于490℃,α′=0.90时,其他条件不变,总反应速率v随着温度升高而降低,原因是_____ 。
(5)判断分子极性:CO是_____ (填“极性”或“非极性”,下同)分子,CO2是_____ 分子。
 2CO2(g)+N2(g) △H=-746.8kJ•mol-1,常用于处理汽车尾气,实验表明,高于120℃且无催化剂时,该反应分三步完成,前两步如下:
2CO2(g)+N2(g) △H=-746.8kJ•mol-1,常用于处理汽车尾气,实验表明,高于120℃且无催化剂时,该反应分三步完成,前两步如下:第1步:2NO(g)
 N2O2(g) △H=-103kJ•mol-1
N2O2(g) △H=-103kJ•mol-1第2步:N2O2(g)+CO(g)
 N2O(g)+CO2(g) △H=-293.5kJ•mol-1
N2O(g)+CO2(g) △H=-293.5kJ•mol-1(1)写出第3步反应的热化学方程式
(2)三步反应中,第2、3步是快反应,第1步是慢反应,请分析决定反应速率的是第
(3)560℃时,向2L恒容密闭容器中充入2molCO和2molNO,反应10min后达到平衡状态,压力传感器测得压强为反应前的76.25%。
①写出总反应2CO(g)+2NO(g)
 2CO2(g)+N2(g)平衡常数的表达式K=
2CO2(g)+N2(g)平衡常数的表达式K=②用N2的浓度变化表示该反应的平均反应速率v(N2)=
(4)高于120℃且无催化剂时,总反应速率v=k•(
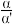 -1)1.2(1-nα′),α是平衡转化率;α′是瞬时转化率;k是速率常数,只受温度影响,温度升高,速率常数增大;n为常数,且nα′<1。
-1)1.2(1-nα′),α是平衡转化率;α′是瞬时转化率;k是速率常数,只受温度影响,温度升高,速率常数增大;n为常数,且nα′<1。①恒温密闭容器中充入CO和NO发生总反应,请画出总反应速率(v)随瞬时转化率(α′)的变化曲线图α′<α)

②实验表明:高于490℃,α′=0.90时,其他条件不变,总反应速率v随着温度升高而降低,原因是
(5)判断分子极性:CO是
您最近一年使用:0次



