 清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。
清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。I.利用
 合成甲醇
合成甲醇
在
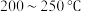 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:反应i:
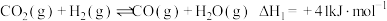
反应ii:

反应iii:
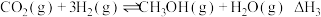
(1)反应ⅲ的焓变
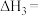
 ;反应iii能自发进行的温度条件是
;反应iii能自发进行的温度条件是(2)该反应条件下,同时存在副反应ⅳ:
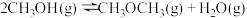 。已知:
。已知: 的沸点为
的沸点为 ,
, 的沸点为
的沸点为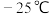 。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因
。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因II.利用
 和甲醇合成碳酸二甲酯
和甲醇合成碳酸二甲酯
反应v:
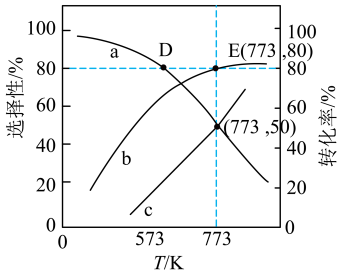
(3)在不同的温度、压强下,一定反应时间内,测定反应ⅴ中甲醇的转化率。甲醇转化率与温度的关系为图a,与压强的关系为图b(曲线未画出)。
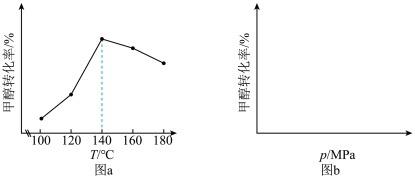
①根据图a判断,反应ⅴ的
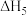
②在
 之间,随着温度升高,甲醇转化率增大的原因可能是
之间,随着温度升高,甲醇转化率增大的原因可能是③在图b中绘制出甲醇转化率与压强的关系曲线
相似题推荐
【推荐1】煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s)+CO2(g) ∆H1= +178.30kJ/mol
②CaO(s)+SO2(g)+0.5O2(g)⇌CaSO4(s) ∆H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g) ∆H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g) ∆H4= +218.92kJ/mol
(1)温度升高,反应①的化学平衡常数
(2)∆H3=
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。
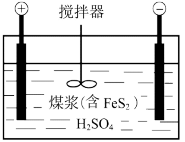
(4)将煤打成煤浆加入电解槽的目的是
(5)阳极的电极反应式为
(6)用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式为(补全并配平):FeS2+·OH =Fe3++SO + H2O +_______
+ H2O +_______
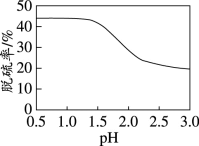
(7)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;
主反应:
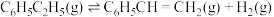

副反应:
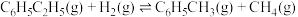

回答下列问题:
(1)已知:在
 、
、 条件下,某些物质的相对能量
条件下,某些物质的相对能量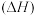 变化关系如图所示。则上述反应中的
变化关系如图所示。则上述反应中的
 。
。
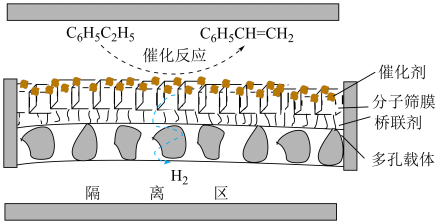
(2)在不同的温度条件下,以水烃比
 投料,在膜反应器中发生乙苯脱氢反应。膜反应器可以通过多孔膜移去
投料,在膜反应器中发生乙苯脱氢反应。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,其原理如图所示。已知:
,提高乙苯的平衡转化率,其原理如图所示。已知: 移出率
移出率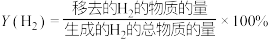 。
。
①若忽略副反应,维持体系总压强
 恒定,在温度为
恒定,在温度为 时,乙苯的平衡转化率为
时,乙苯的平衡转化率为 ,
, 的移出率为
的移出率为 ,则在该温度下主反应的平衡常数
,则在该温度下主反应的平衡常数
 、
、 、
、 的代数式表示)。[对于气相反应,用某组分
的代数式表示)。[对于气相反应,用某组分 的平衡压强
的平衡压强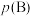 代替物质的量浓度
代替物质的量浓度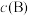 ,也可表示平衡常数,记作
,也可表示平衡常数,记作 ,如
,如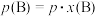 ,
, 为平衡总压强,
为平衡总压强,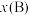 为平衡系统中
为平衡系统中 的物质的量分数]
的物质的量分数]②乙苯的平衡转化率增长百分数与
 的移出率在不同温度条件下的关系如下表:
的移出率在不同温度条件下的关系如下表:| 温度/℃ 增长百分数/%  移出率/% 移出率/% | 700 | 950 | 1000 |
| 60 | 8.43 | 4.38 | 2.77 |
| 80 | 16.8 | 6.1 | 3.8 |
| 90 | 27 | 7.1 | 4.39 |
 时 ,乙苯的平衡转化率随
时 ,乙苯的平衡转化率随 的移出率的变化改变程度不大,原因是
的移出率的变化改变程度不大,原因是③下列说法正确的是
A.生成
 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等B.因为
 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.膜反应器可降低主反应的活化能,提高主反应的选择性
(3)一种将电氧化法和电还原法联合处理含甲醛的废水的装置如图所示。
①阴极的电极反应为
②当外电路通过
 电子时,理论上能处理的甲醛的质量为
电子时,理论上能处理的甲醛的质量为(1)写出高湿条件下,空气中的SO2转化成硫酸酸雨的化学方程式
(2)土壤中的微生物可将大气中的H2S分两步氧化成
 ,两步反应的能量变化如图甲所示:
,两步反应的能量变化如图甲所示:
1 mol H2S(g)全部氧化成
 (aq)的热化学方程式为
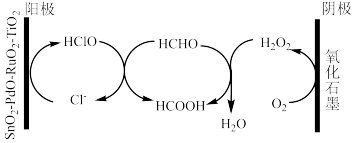
(aq)的热化学方程式为(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图乙所示。电路中每通过2mol电子,负极消耗的H2S在标准状况下的体积为
(4)在一定条件下,二氧化硫和氧气发生反应: 2SO2(g) + O2(g)
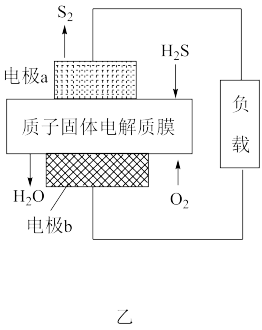
 2SO3(g)。600°C时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10 min和20 min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图丙所示。
2SO3(g)。600°C时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10 min和20 min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图丙所示。
①曲线
②根据图丙判断,10 min时改变的条件可能是
A.加入催化剂
B.分离出SO3
C.降低温度
D.增加O2的物质的量
③该条件下,反应2SO2(g)+O2(g)
 2SO3(g)的平衡常数为
2SO3(g)的平衡常数为反应Ⅰ:
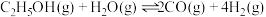
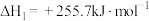
反应Ⅱ:
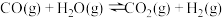
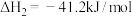
已知相关键能数据如下表:
| 化学键 |  |  |  |  |
键能/ | 436 | 464.4 | a | 1072 |
(1)

 ,反应Ⅰ自发进行的条件是
,反应Ⅰ自发进行的条件是A.高压 B.低压 C.高温 D.低温
(2)向某恒容密闭容器中充入
 和
和 ,起始压强为
,起始压强为 ,若仅发生上述反应,平衡时
,若仅发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的变化曲线如图所示[已知:
的选择性、乙醇的转化率随温度的变化曲线如图所示[已知: 的选择性
的选择性 ]。
]。
 的选择性的是曲线
的选择性的是曲线②反应Ⅱ的平衡常数:

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。③下列能提高平衡时乙醇转化率的措施有
A.适当减小压强 B.选用高效催化剂 C.增大
 的投料 D.适当升高温度
的投料 D.适当升高温度④设
 为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。
。 时,反应Ⅰ的相对压力平衡常数为
时,反应Ⅰ的相对压力平衡常数为
(3)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。

②电池工作时正极区溶液的

③外电路通过
 电子,体系中水增多
电子,体系中水增多 。
。
Ⅰ.CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1Ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2Ⅲ.CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3回答下列问题
(1)反应(Ⅰ)的△S
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
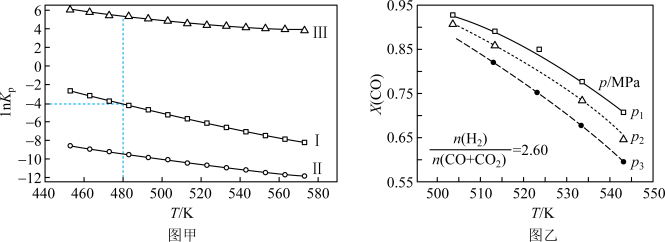
①反应(Ⅱ)的△H
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=
(3)若用CO和CO2混合气体合成甲醇,起始时均控制
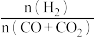 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大
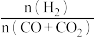 ,X(CO)增大
,X(CO)增大
 气体的产生量逐年升高。
气体的产生量逐年升高。 是温室气体,也是破坏臭氧层的气体。
是温室气体,也是破坏臭氧层的气体。(1)用Fe掺杂六方氮化硼作催化剂将
 还原为
还原为 。Fe为催化剂的活性中心,用*Fe表示,反应分为:
。Fe为催化剂的活性中心,用*Fe表示,反应分为: 、
、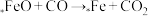 两个过程,掺杂时Fe替代六方氮化硼中部分的
两个过程,掺杂时Fe替代六方氮化硼中部分的(2)已知:①

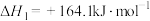
②
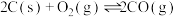
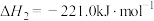
③
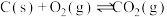
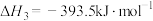
则反应
 的
的
 。
。(3)反应:
 ,起始
,起始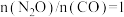 时,在不同条件下达到平衡,体系中
时,在不同条件下达到平衡,体系中 的物质的量分数为
的物质的量分数为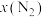 ,在温度为(a+40)K下的
,在温度为(a+40)K下的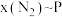 。在
。在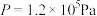 下的
下的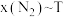 如图所示。图中对应等压过程的曲线为
如图所示。图中对应等压过程的曲线为
(4)
 在金(Au)表面分解反应为
在金(Au)表面分解反应为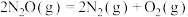 ,速率方程为
,速率方程为 (k为速率常数)。实验数据如表所示。
(k为速率常数)。实验数据如表所示。| t/min | 0 | 20 | 40 | 60 | 80 | 100 |
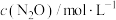 | 0.100 | 0.080 | 0.060 | 0.040 | 0.020 | 0.000 |
 ,则半衰期(浓度减少一半所需的时间)=
,则半衰期(浓度减少一半所需的时间)= 和
和 气体通入体积为
气体通入体积为 的密闭容器中(容积不变),发生如下反应:
的密闭容器中(容积不变),发生如下反应: 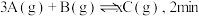 时反应达到平衡状态(温度不变),剩余
时反应达到平衡状态(温度不变),剩余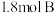 ,并测得C的浓度为
,并测得C的浓度为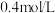 ,请填写下列空白:
,请填写下列空白:(1)x=
(2)比较达到平衡时,A、B两反应物的转化率:
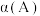
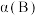 (填>、=或<)
(填>、=或<)(3)若继续向原平衡混合物的容器中通入少量氨气(氨气和A、B、C都不反应)后,下列说法中正确的是_______(填写字母序号)
| A.化学平衡向正反应方向移动 |
| B.化学平衡向逆反应方向移动 |
| C.化学平衡不会发生移动 |
| D.正、逆反应的化学反应速率将发生同等程度的改变 |
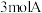 和
和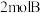 ,在
,在 时达到新的平衡,此时B的物质的量为
时达到新的平衡,此时B的物质的量为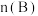
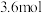 。(填“>”、“<”、或“=”)
。(填“>”、“<”、或“=”)(5)如果将
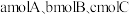 在相同温度和容器中进行反应。欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量
在相同温度和容器中进行反应。欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量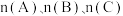 间应该满足的等量关系式:
间应该满足的等量关系式:(1)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2∶1的
 和
和 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡: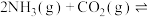
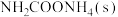
 ,反应过程中氨气质量与时间关系如图所示:
,反应过程中氨气质量与时间关系如图所示: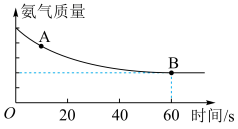
A点正反应速率
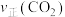
 (填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中
(填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中 的体积分数与原平衡相比
的体积分数与原平衡相比(2)温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol
 ,发生反应:
,发生反应: ,反应相同时间,测得各容器中
,反应相同时间,测得各容器中 的转化率与容器体积的关系如下图所示。
的转化率与容器体积的关系如下图所示。
下列说法正确的是
A.容器内的压强:
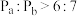
B.图中c点所示条件下,

C.向a点平衡体系中充入一定量的
 ,达到平衡时,
,达到平衡时, 的转化率比原平衡大
的转化率比原平衡大(3)电解法制取
 ,同时可获得氢气:
,同时可获得氢气: ,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质:
,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质: 只在强碱性条件下稳定。
只在强碱性条件下稳定。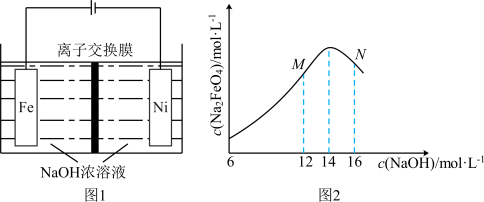
①电解时,Fe电极发生的电极反应式为
②
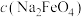 随初始
随初始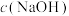 的变化如图2,则分别分析M、N点
的变化如图2,则分别分析M、N点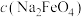 均低于最高值的可能的原因:M点
均低于最高值的可能的原因:M点(4)甲醚(
 )是重要的化工原料,制取原理如下:
)是重要的化工原料,制取原理如下:主反应①:
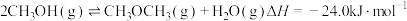 。
。副反应②:
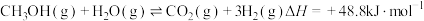 。
。选择合适的催化剂。在不同温度和5MPa压强下,测得甲醚的选择性如下图所示。
 的选择性=(2×
的选择性=(2× 的物质的量/反应的
的物质的量/反应的 的物质的量)×100%
的物质的量)×100%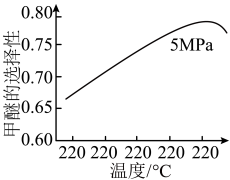
图中,温度高于265℃后甲醚选择性降低,从平衡的角度分析,其可能的原因是
 载氧体的丙烷化学链燃烧技术原理如图所示。
载氧体的丙烷化学链燃烧技术原理如图所示。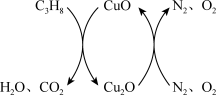
空气反应器与燃料反应器中发生的反应分别如下:
反应1:

反应2:

反应3:
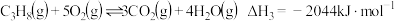
请回答下列问题:
(1)反应1在
(2)反应2的平衡常数表达式


 。
。(3)一定温度下,在容积可变的密闭容器中加入足量
 和适量的
和适量的 发生反应1,达到平衡时测得气体压强为
发生反应1,达到平衡时测得气体压强为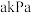 。
。①温度不变,将容器体积扩大至原来的2倍且不再改变,达到新的平衡时,气体压强
 。
。②当
 的质量不变时,
的质量不变时,③若达到平衡之后,保持恒温恒容条件下再充入少量
 ,平衡
,平衡 的平衡转化率
的平衡转化率(4)在一定温度下,总压强恒定为
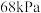 ,在密闭容器中加入丙烷和氨气的混合气体以及足量
,在密闭容器中加入丙烷和氨气的混合气体以及足量 ,只发生上述反应2(氨气不参与反应),测得丙烷的平衡转化率与投料比
,只发生上述反应2(氨气不参与反应),测得丙烷的平衡转化率与投料比 的关系如图所示。随着投料比
的关系如图所示。随着投料比 增大,
增大, 的平衡转化率减小的原因是
的平衡转化率减小的原因是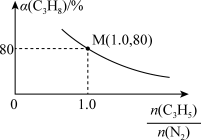
 ,油气脱硫一直是石油工业研究的重点。
,油气脱硫一直是石油工业研究的重点。(1)输油、输气的钢管被原油、天然气中的含硫化合物腐蚀属于
(2)石化工业,常采用碳酸钠溶液作为脱硫吸收剂。
①已知:
 ,
,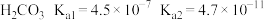 ;
;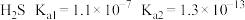 。请写出
。请写出 与足量碳酸钠溶液反应的离子方程式:
与足量碳酸钠溶液反应的离子方程式:②工业生产中常采用从吸收塔顶淋入吸收液、塔底通入待处理油气的逆流喷淋吸收法,这样做的好处是
(3)
 与
与 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: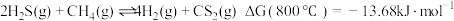
①该反应在给定条件下是否能自发进行?
在研究反应发生的适宜条件时,发现:过多的
 会导致
会导致 催化剂失活;
催化剂失活; 助剂有稳定催化剂的作用。同时,得出一组图像,请根据图中信息回答问题:
助剂有稳定催化剂的作用。同时,得出一组图像,请根据图中信息回答问题: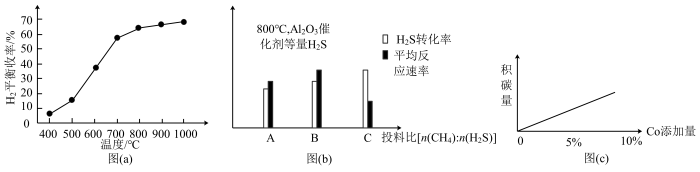
②图(a)为随温度升高,氢气平衡收率图,由图像可知该反应正向

③图(b)为
 ,
, 催化剂条件下投入等量
催化剂条件下投入等量 ,投料比[
,投料比[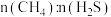 ]分别为1∶1,1∶3、12∶1达平衡时
]分别为1∶1,1∶3、12∶1达平衡时 转化率、平均反应速率图。请判断投料比
转化率、平均反应速率图。请判断投料比 对应图中
对应图中④未添加
 助剂时,无积碳,随着
助剂时,无积碳,随着 添加量的变化,积碳量变化如图(c)所示,由此可推知,
添加量的变化,积碳量变化如图(c)所示,由此可推知, 助剂可能催化了原料气发生的
助剂可能催化了原料气发生的(4)油气脱硫也可以采用电解法,原理如图所示:
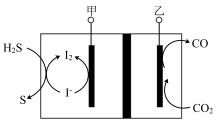
请写出甲电极所在区域发生的总电极反应式:
 合成其它高价值化学品的工业生产显得更加重要。
合成其它高价值化学品的工业生产显得更加重要。(1)工业上以煤和水为原料通过一系列转化可获得清洁能源氢气。
已知:①
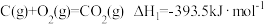
②

③
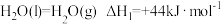
则碳与水蒸气反应
 的
的
(2)工业上也可以仅利用上述反应得到的
 和
和 进一步合成甲醇:
进一步合成甲醇: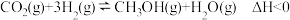
①在某1L恒温恒容密闭容器中充入
 和
和 发生反应,测得
发生反应,测得 和
和 浓度随时间变化如下图1所示。则平衡时
浓度随时间变化如下图1所示。则平衡时 的转化率为
的转化率为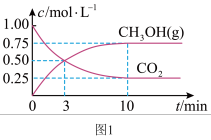
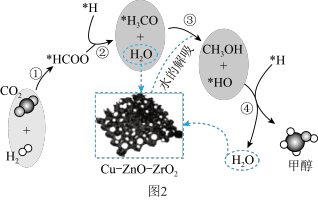
②该反应在催化剂
 表面进行,主反应历程如图2所示(催化剂表面吸附的物种用·标注),下列说法不正确的是
表面进行,主反应历程如图2所示(催化剂表面吸附的物种用·标注),下列说法不正确的是a.该反应的原子利用率为100%
B.催化剂可以降低反应活化能
C.反应②中,断裂和形成的共价键至少有2种
D.使用催化剂可以提高反应的转化率
(3)将合成的甲醇进行水蒸气重整是电动汽车氢氧燃料电池理想的氢源。该制氢(SRM)系统简单,产物中
 含量高、CO含量低(CO会损坏燃料电池的交换膜),反应如下:
含量高、CO含量低(CO会损坏燃料电池的交换膜),反应如下:反应I(主):
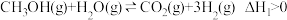
反应II(副):
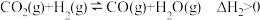
温度高于300℃会同时发生反应Ⅲ:
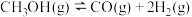
①反应I能够自发进行的条件是
②升温有利于提高
 转化率,但也存在一个明显的缺点是
转化率,但也存在一个明显的缺点是③写出一条能提高
 转化率而降低CO生成率的措施
转化率而降低CO生成率的措施(1)丙烷经催化脱氢可制丙烯:

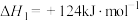 ,该反应自发进行的条件是
,该反应自发进行的条件是 的平衡转化率,又能增大生成
的平衡转化率,又能增大生成 的反应速率的是
的反应速率的是a.升高温度 b.增大压强 c.加入催化剂 d.恒容条件增加
 的量
的量(2)已知丙烷和丙烯的燃烧热分别为
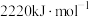 和
和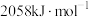 ,则丙烷氧化脱氢反应:
,则丙烷氧化脱氢反应: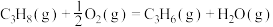

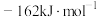 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)温度一定时,假定体系内只有反应
 发生,反应过程中压强恒定为
发生,反应过程中压强恒定为 (即
(即 的初始压强),平衡转化率为
的初始压强),平衡转化率为 ,该反应的平衡常数
,该反应的平衡常数 为
为 总压
总压 物质的量分数)。
物质的量分数)。(4)在上述体系中压强恒定为
 和
和 下,丙烷平衡转化率与温度的关系如下左图所示。
下,丙烷平衡转化率与温度的关系如下左图所示。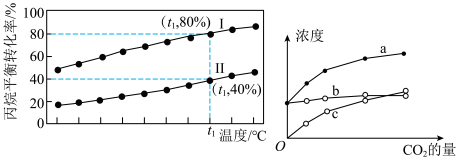

 。计算结果保留一位小数)
。计算结果保留一位小数)(5)在催化剂条件下,向恒温恒容的
 平衡体系中通入不同量的
平衡体系中通入不同量的 。
。已知:

经相同时间,体系中
 、CO和
、CO和 浓度随初始通入
浓度随初始通入 量的关系如上右图。
量的关系如上右图。由图可知,其中曲线b代表的产物是



