回答下列问题:
(1)磷元素的含氧酸有: 、
、 (亚磷酸)、
(亚磷酸)、 (次磷酸)等多种。已知:
(次磷酸)等多种。已知: 与过量NaOH溶液反应的离子方程式为
与过量NaOH溶液反应的离子方程式为 ,所得产物
,所得产物 的水溶液显碱性。
的水溶液显碱性。
①由此判断 属于
属于___________ (填“一”“二”或“三”)元___________ (填“强”或“弱”)酸。
② 属于
属于___________ (填“正盐”“酸式盐”或“碱式盐”)。
③次磷酸 可将溶液中的
可将溶液中的 转化为银,自身变为
转化为银,自身变为 ,可用于化学镀银。利用
,可用于化学镀银。利用 进行化学镀银的反应中,氧化剂与还原剂的个数之比为
进行化学镀银的反应中,氧化剂与还原剂的个数之比为___________ 。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:_______ 。

(3) 催化氧化的化学方程式为
催化氧化的化学方程式为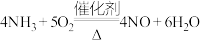 ,该反应的还原产物是
,该反应的还原产物是___________ 。
(4)已知反应方程式: ,当反应消耗15molHCl时,转移的电子数目为
,当反应消耗15molHCl时,转移的电子数目为___________ (设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)磷元素的含氧酸有:
 、
、 (亚磷酸)、
(亚磷酸)、 (次磷酸)等多种。已知:
(次磷酸)等多种。已知: 与过量NaOH溶液反应的离子方程式为
与过量NaOH溶液反应的离子方程式为 ,所得产物
,所得产物 的水溶液显碱性。
的水溶液显碱性。①由此判断
 属于
属于②
 属于
属于③次磷酸
 可将溶液中的
可将溶液中的 转化为银,自身变为
转化为银,自身变为 ,可用于化学镀银。利用
,可用于化学镀银。利用 进行化学镀银的反应中,氧化剂与还原剂的个数之比为
进行化学镀银的反应中,氧化剂与还原剂的个数之比为(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:

(3)
 催化氧化的化学方程式为
催化氧化的化学方程式为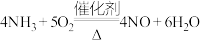 ,该反应的还原产物是
,该反应的还原产物是(4)已知反应方程式:
 ,当反应消耗15molHCl时,转移的电子数目为
,当反应消耗15molHCl时,转移的电子数目为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
更新时间:2023-12-12 21:06:44
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】下面两个方法都可以用来制氯气:
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。根据以上两个反应,回答下列有关问题:
(1)反应①的离子方程式为____________ 。
(2)浓盐酸在反应①中显示出来的性质是____________ 。
A.还原性B.氧化性C.酸性
若有17.4gMnO2参与反应,则被氧化的HCl的质量为____________ g。
(3)用双线桥法表示该反应②中电子转移的方向和数目。____________
(4)若要制得相同质量的氯气,反应①②中电子转移的数目之比为____________ 。
(5)已知反应④:4HCl+O2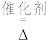 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为____________ 。
①MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。根据以上两个反应,回答下列有关问题:
(1)反应①的离子方程式为
(2)浓盐酸在反应①中显示出来的性质是
A.还原性B.氧化性C.酸性
若有17.4gMnO2参与反应,则被氧化的HCl的质量为
(3)用双线桥法表示该反应②中电子转移的方向和数目。
(4)若要制得相同质量的氯气,反应①②中电子转移的数目之比为
(5)已知反应④:4HCl+O2
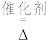 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在高锰酸钾固体上滴加浓盐酸,马上产生黄绿色气体。反应的化学方程式为:2KMnO4 + 16HCl=2KC1 + 2MnCl2 + 5C12↑+ 8H2O
回答下列问题:
(1)此反应中的氧化剂是____ ,当在标准状况下产生0.112L氯气,转移的电子数为____ mol。
(2)氯原子的核电荷数为______ ;氧原子的原子结构示意图_______ 。
(3)在KC1固体中存在的化学键是__________ ;写出H2O电子式_________ 。
(4)工业上用氯气与消石灰作原料制造漂粉精,此反应的化学方程式是_________ 。
(5)浓盐酸的溶质是氯化氢,用一个实验证明氯化氢极易溶于水。_________ 。
回答下列问题:
(1)此反应中的氧化剂是
(2)氯原子的核电荷数为
(3)在KC1固体中存在的化学键是
(4)工业上用氯气与消石灰作原料制造漂粉精,此反应的化学方程式是
(5)浓盐酸的溶质是氯化氢,用一个实验证明氯化氢极易溶于水。
您最近一年使用:0次
【推荐3】Ⅰ.某地环保部门取一定量某工厂所排酸性废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知:废水试样中除H+外可能含有表中的离子:
请回答下列问题:
(1)离子X是_______ (填化学式,下同),离子Y是_______ 。
(2)表中不能确定是否存在的阴离子是_______ ,能证明该阴离子是否存在的简单实验操作为_______ 。
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式:_______ 。
Ⅱ.某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如图:

(4)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_______ 。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为_______ 。(假设反应前后溶液的体积不变)
(5)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题_______ 。

已知:废水试样中除H+外可能含有表中的离子:
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO 、Y、NO 、Y、NO |
请回答下列问题:
(1)离子X是
(2)表中不能确定是否存在的阴离子是
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式:
Ⅱ.某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如图:

(4)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为
(5)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题
您最近一年使用:0次
【推荐1】回答下列问题
(1)已知某反应体系中有如下反应物和生成物: ,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍
,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍
①已知KMnO4 在反应中得电子,写出该反应的化学方程式_________
②已知当生成标准状况下2.24L气体X时,消耗的氧化剂的物质的量为_________
③根据该反应事实可知_________
A.氧化性:X>KMnO4 B.氧化性:KMnO4 >X
C.还原性:HCl>MnCl2 D.还原性:MnCl2 > HCl
(2)配平下列离子反应方程式
①_____KI+_____KIO3+_____H2SO4___________I2+_____K2SO4+_____H2O;____
②_____S+_____KOH___________K2S+_____K2SO3+_____H2O;_________
③_____ClO +_____Fe2++________Cl-+_____Fe3++______________;
+_____Fe2++________Cl-+_____Fe3++______________;_________
(1)已知某反应体系中有如下反应物和生成物:
 ,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍
,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍①已知KMnO4 在反应中得电子,写出该反应的化学方程式
②已知当生成标准状况下2.24L气体X时,消耗的氧化剂的物质的量为
③根据该反应事实可知
A.氧化性:X>KMnO4 B.氧化性:KMnO4 >X
C.还原性:HCl>MnCl2 D.还原性:MnCl2 > HCl
(2)配平下列离子反应方程式
①_____KI+_____KIO3+_____H2SO4___________I2+_____K2SO4+_____H2O;
②_____S+_____KOH___________K2S+_____K2SO3+_____H2O;
③_____ClO
 +_____Fe2++________Cl-+_____Fe3++______________;
+_____Fe2++________Cl-+_____Fe3++______________;
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)现有以下物质:①NaCl晶体②液态HCl③CaCO3固体④熔融KCl⑤蔗糖⑥CO2⑦铜⑧H2SO4⑨KOH固体
以上物质中能导电的是__ 。以上物质中属于电解质的是__ ,属于非电解质的是__ 。以上物质中,溶于水且能导电的物质是__ 。
(2)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___ mol·L−1。
(3)黑火药爆炸发生时:2KNO3+S+3C=K2S+N2↓,2molKNO3氧化碳的物质的量为:__ 。
(4)已知Br2+2Fe2+=2Fe3++2Br-,向1L0.1mol/L的FeBr2溶液中通入标准状况下2.24L的氯气,反应的离子方程式:__ 。
以上物质中能导电的是
(2)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为
(3)黑火药爆炸发生时:2KNO3+S+3C=K2S+N2↓,2molKNO3氧化碳的物质的量为:
(4)已知Br2+2Fe2+=2Fe3++2Br-,向1L0.1mol/L的FeBr2溶液中通入标准状况下2.24L的氯气,反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
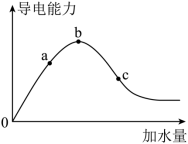
(1)“O”点导电能力为0的理由是_______ ;
(2)a、b、c三点溶液中c(H+)由小到大的顺序为_______ ;
(3)a、b、c三点中醋酸电离程度最大的是_______ ;
(4)若使c点溶液的c(CH3COO-)提高,溶液的c(H+)减小,可采取的措施是加入_______。
①盐酸 ②冰醋酸 ③固体KOH ④加水 ⑤固体CH3COONa ⑥Zn粒

(1)“O”点导电能力为0的理由是
(2)a、b、c三点溶液中c(H+)由小到大的顺序为
(3)a、b、c三点中醋酸电离程度最大的是
(4)若使c点溶液的c(CH3COO-)提高,溶液的c(H+)减小,可采取的措施是加入_______。
①盐酸 ②冰醋酸 ③固体KOH ④加水 ⑤固体CH3COONa ⑥Zn粒
| A.①②③④⑤⑥ | B.①②③⑥ | C.①②⑤⑥ | D.③⑤⑥ |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】依据醋酸的性质,请回答下列问题(以下讨论均在常温时)。
(1)取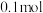 (冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
(冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
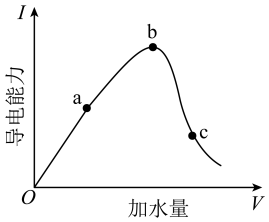
① 的电离方程式是
的电离方程式是_______ 。
②a、b、c三点中 最小的是
最小的是_______ ,电离程度最大的是_______ 。
③在稀释过程中,
_______ (填“先怎么变后怎么变”)。
(2)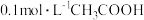 溶液的
溶液的 ,该溶液中由水电离出的
,该溶液中由水电离出的 浓度是
浓度是_______  。
。
(3)向相同的两密闭容器中加入0.05g镁条,分别注入 盐酸、
盐酸、 醋酸,测得容器内压强随时间变化如下图所示。
醋酸,测得容器内压强随时间变化如下图所示。
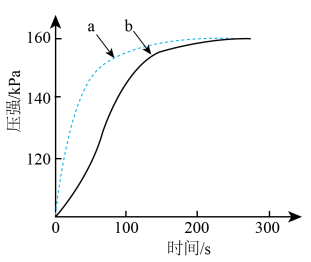
①反应为醋酸的曲线是_______ (填字母)。
②反应开始时反应速率 的原因是
的原因是_______ 。
(1)取
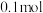 (冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
(冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
①
 的电离方程式是
的电离方程式是②a、b、c三点中
 最小的是
最小的是③在稀释过程中,

(2)
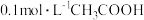 溶液的
溶液的 ,该溶液中由水电离出的
,该溶液中由水电离出的 浓度是
浓度是 。
。(3)向相同的两密闭容器中加入0.05g镁条,分别注入
 盐酸、
盐酸、 醋酸,测得容器内压强随时间变化如下图所示。
醋酸,测得容器内压强随时间变化如下图所示。
①反应为醋酸的曲线是
②反应开始时反应速率
 的原因是
的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
①亚硫酸发生电离的方程式为____________________________________________ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:_____________________ 。
③在相同条件下,试比较 、
、 和
和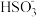 的酸性强弱:
的酸性强弱:_______ > ______ >_______ 。
④将pH=4的 溶液稀释100倍后溶液的pH范围是
溶液稀释100倍后溶液的pH范围是______________________ ,图中的纵坐标可以是_______________________ 。
a.溶液的pH b.醋酸的电离平衡常数 c.溶液的导电能力 d.醋酸的电离程度
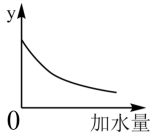
⑤若醋酸的初始浓度为0.01 mol/L,平衡时氢离子浓度是________________________ (写出详细解题步骤)
⑥写出亚硫酸氢钠与碳酸钠反应的离子方程式_________________________
| 酸 | 电离平衡常数 |
| 醋酸 |  |
| 碳酸 |  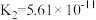 |
| 亚硫酸 | 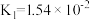  |
①亚硫酸发生电离的方程式为
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较
 、
、 和
和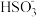 的酸性强弱:
的酸性强弱:④将pH=4的
 溶液稀释100倍后溶液的pH范围是
溶液稀释100倍后溶液的pH范围是a.溶液的pH b.醋酸的电离平衡常数 c.溶液的导电能力 d.醋酸的电离程度

⑤若醋酸的初始浓度为0.01 mol/L,平衡时氢离子浓度是
⑥写出亚硫酸氢钠与碳酸钠反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)常温下,将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________ .(溶液体积变化忽略不计)
(2)常温下,将均为0.1 mol/L的盐酸和氨水溶液等体积混合后,溶液呈___ 性,则溶液中c( )
)_____ c(Cl-)(填“>”、“<”或“=”)。
(3)pH相同的盐酸和醋酸溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________ n(填“>”、“<”或“=”);
(4)已知相同温度下电离常数K(HF)>K(HCN),在物质的量浓度均为0.1mol/L的NaCN和NaF的混合溶液中c(F-)_____ c(CN-)(填“>”、“<”或“=”)。
(2)常温下,将均为0.1 mol/L的盐酸和氨水溶液等体积混合后,溶液呈
 )
)(3)pH相同的盐酸和醋酸溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m
(4)已知相同温度下电离常数K(HF)>K(HCN),在物质的量浓度均为0.1mol/L的NaCN和NaF的混合溶液中c(F-)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】亚硝酸(HNO2)为一元弱酸。已知:25℃时,四种物质的电离平衡常数(K)如表。
(1)下列不能说明HNO2是弱电解质的是___ (填字母)。
a.常温下0.1 mol·L-1NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.0.1 mol·L-1HNO2溶液与等体积0.1 mol·L-1NaOH溶液恰好反应
d.常温下,0.1 mol·L-1HNO2溶液的pH=2.3
(2)25℃时,将10 mL0.1 mol·L-1的亚硝酸溶液与10 mL0.1 mol·L-1氨水混合,所得溶液呈___ (填“酸性”“碱性”或“中性”)。25℃时,将10 mLpH=3的亚硝酸溶液与10 mLpH=11氨水混合,所得溶液呈___ (填“酸性”“碱性”或“中性”),该溶液中各离子浓度由大到小的顺序为___ 。
(3)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___ 。
| 酸 | HNO2 | NH3·H2O | H2CO3 | H2SO3 |
| K | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-2 Ka2=6.3×10-8 |
(1)下列不能说明HNO2是弱电解质的是
a.常温下0.1 mol·L-1NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.0.1 mol·L-1HNO2溶液与等体积0.1 mol·L-1NaOH溶液恰好反应
d.常温下,0.1 mol·L-1HNO2溶液的pH=2.3
(2)25℃时,将10 mL0.1 mol·L-1的亚硝酸溶液与10 mL0.1 mol·L-1氨水混合,所得溶液呈
(3)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】有下列四种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3。
(1)写出①溶液的电荷守恒:____________ 。
(2)常温下,0.1 mol·L-1④溶液的pH大于8,则溶液中c(H2CO3)_____ c(CO32-)(填“>”、“=”或“<”),原因是_______ (用离子方程式和必要的文字说明)。
(3)常温下0.1 mol/L的③溶液加水稀释过程中,下列表达式的数据一定变大的是_________ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________ (用离子方程式解释)
(1)写出①溶液的电荷守恒:
(2)常温下,0.1 mol·L-1④溶液的pH大于8,则溶液中c(H2CO3)
(3)常温下0.1 mol/L的③溶液加水稀释过程中,下列表达式的数据一定变大的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)用②和④的溶液可以制作泡沫灭火剂,其原理为:
您最近一年使用:0次



