工业尾气H2S对环境和人体健康会产生严重危害,回收H2S制备高附加值的硫磺是保护环境和资源利用的有效措施。
已知:2H2S(g)⇌2H2(g)+S2(g) △H=+169.8kJ/mol。
回答下列问题:
(1)上述反应中相关键能数据:
①反应能自发进行的条件是___________ ,a=___________  。
。
②在恒温恒容密闭容器中,充入一定量 气体发生上述反应,下列说法正确的是
气体发生上述反应,下列说法正确的是___________ (填标号)。
A. 的体积分数不再改变,说明该反应达到平衡
的体积分数不再改变,说明该反应达到平衡
B. 与
与 体积比不再改变,说明该反应达到平衡
体积比不再改变,说明该反应达到平衡
C.平衡时向容器中充入情性气体,平衡正向移动
D.平衡时向容器中充入 和
和 ,再达平衡时,
,再达平衡时, 不变
不变
(2)保持压强恒定为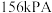 ,向密闭容器中充入
,向密闭容器中充入 和
和 (
( 不参与反应)发生上述反应,
不参与反应)发生上述反应, 的平衡转化率
的平衡转化率 ]与通入气体中
]与通入气体中 、温度
、温度 关系如下图所示。
关系如下图所示。

①从反应开始至反应体系分别达到M、N点状态,平均反应速率较快的是达到___________ (填“M”或“N”)的过程。
②相同温度下,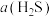 随着x增大而减小,其原因是
随着x增大而减小,其原因是___________ 。
已知:2H2S(g)⇌2H2(g)+S2(g) △H=+169.8kJ/mol。
回答下列问题:
(1)上述反应中相关键能数据:
| 化学键 |  |  |  |
键能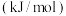 | a | 329 | 436 |
 。
。②在恒温恒容密闭容器中,充入一定量
 气体发生上述反应,下列说法正确的是
气体发生上述反应,下列说法正确的是A.
 的体积分数不再改变,说明该反应达到平衡
的体积分数不再改变,说明该反应达到平衡B.
 与
与 体积比不再改变,说明该反应达到平衡
体积比不再改变,说明该反应达到平衡C.平衡时向容器中充入情性气体,平衡正向移动
D.平衡时向容器中充入
 和
和 ,再达平衡时,
,再达平衡时, 不变
不变(2)保持压强恒定为
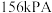 ,向密闭容器中充入
,向密闭容器中充入 和
和 (
( 不参与反应)发生上述反应,
不参与反应)发生上述反应, 的平衡转化率
的平衡转化率 ]与通入气体中
]与通入气体中 、温度
、温度 关系如下图所示。
关系如下图所示。
①从反应开始至反应体系分别达到M、N点状态,平均反应速率较快的是达到
②相同温度下,
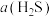 随着x增大而减小,其原因是
随着x增大而减小,其原因是
2023高三·全国·专题练习 查看更多[1]
(已下线)化学平衡状态 平衡移动
更新时间:2023-12-15 18:23:36
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】MnO是离子晶体,其晶格能可通过如图的Born—Haber循环计算得到。
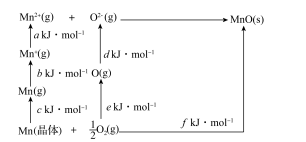
Mn的第一电离能是__ (数值用图中字母表示,下同),O2的键能是__ ,MnO的晶格能是__ 。

Mn的第一电离能是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,请参考题中图表,根据要求回答问题:

(1)图21-1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_____ (填“增大”、“减小”或“不变”,下同),ΔH的变化是______ 。请写出NO2和CO反应的热化学方程式:______________ 。
(2)如下表所示是部分化学键的键能参数:
已知白磷的燃烧热为dkJ·mol-1,白磷及其完全燃烧的产物的结构如图21-2所示,则表中x=_________________ kJ·mol-1(用含a、b、c、d的代表数式表示)。

(1)图21-1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是
(2)如下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O==O | P==O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为dkJ·mol-1,白磷及其完全燃烧的产物的结构如图21-2所示,则表中x=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】由于石油资源有限,且汽油燃烧会产生严重的污染,未来将用氢气作为燃料来取代汽油,生产21世纪环保汽车。已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1;H2O(l)=H2O(g) ΔH=+44kJ·mol-1
(1)写出氢气和氧气反应生成液态水的热化学方程式:____ 。
(2)若要得到857.4kJ的热量,至少需氢气的质量为____ ,这些氢气在标准状况下的体积为____ 。
(3)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH
CO2(g)+4H2(g) ΔH
反应过程中能量变化如图所示,则该反应为反应____ (填“吸热”或“放热”)

若已知,破坏1mol化学键需要吸收的热量如下表所示:
则该反应的ΔH为_____ (用含a、b、c、d字母的代数式表示)。
(1)写出氢气和氧气反应生成液态水的热化学方程式:
(2)若要得到857.4kJ的热量,至少需氢气的质量为
(3)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ΔH
CO2(g)+4H2(g) ΔH反应过程中能量变化如图所示,则该反应为反应

若已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C—H | O—H | C=O | H—H |
| 吸收热量(kJ/mol) | a | b | c | d |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】碳及其化合物与人类生产、 生活密切相关。请回答下列问题:
(1)羰基硫(O=C=S) 能引起催化剂中毒和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应原理为:
①氢解反应: COS(g)+H2(B) H2S(g)+CO(g) △H1
H2S(g)+CO(g) △H1
②水解反应: COS(g)+H2O(g) H2S(g)+CO2(g) △H2=-35 kJ·mol-1
H2S(g)+CO2(g) △H2=-35 kJ·mol-1
已知CO(g)+H2O(g) H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=
H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=______ ,羰基硫氢解反应_________ (填“能”或“示能”) 设计成原电池。若平衡常数K 与温度T之间存在1gK=a/T+b (a、b为常数) 的线性关系,图中直线符合该氢解反应平衡常数K与温度T关系的是_________ (填字母)。

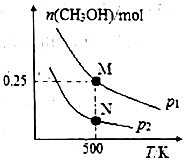
(2)CO 可以合成甲醇 CO(g)+2H2(g) CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为
CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为_________ ;反应速率N 点v 正(CO)_________ M 点v逆(CO) (填“>”“<”或“=”)。
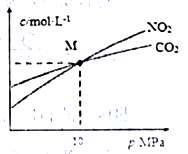
(3)焦炭还原NO2 发生反应2NO2(g)+2C(s) N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=
N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=_________ (Kp是用平衡分压代替平衡浓度表达反应的平衡常数,分压=总压×物质的量分数)。
(4)常温下,用氨水吸收CO2得到NH4HCO3溶液。在NH4HCO3 溶液中c(NH4+)________ c(HCO3-)(填“>”“<”或“=”)
。反应NH4++HCO3-+ H2O NH3· H2O +H2CO3 的平衡常数K=
NH3· H2O +H2CO3 的平衡常数K=_________ 。(已知常温下H2CO3的Ka1=4×10-7mol·L-1,Ka2=4×10-11 mol·L-1,NH3·H2O 的Kb=2×10-5mol·L-1)
(1)羰基硫(O=C=S) 能引起催化剂中毒和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应原理为:
①氢解反应: COS(g)+H2(B)
 H2S(g)+CO(g) △H1
H2S(g)+CO(g) △H1②水解反应: COS(g)+H2O(g)
 H2S(g)+CO2(g) △H2=-35 kJ·mol-1
H2S(g)+CO2(g) △H2=-35 kJ·mol-1已知CO(g)+H2O(g)
 H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=
H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=
(2)CO 可以合成甲醇 CO(g)+2H2(g)
 CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为
CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为
(3)焦炭还原NO2 发生反应2NO2(g)+2C(s)
 N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=
N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=
(4)常温下,用氨水吸收CO2得到NH4HCO3溶液。在NH4HCO3 溶液中c(NH4+)
。反应NH4++HCO3-+ H2O
 NH3· H2O +H2CO3 的平衡常数K=
NH3· H2O +H2CO3 的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】K2Cr2O7溶液中存在平衡: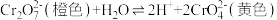 。
。
(1)向2mL0.1mol/LK2Cr2O7溶液中滴加5滴6mol/LNaOH溶液。可观察到的现象是_______ ;得出的结论是:_______ 。
(2)向上述溶液中再滴加10滴6mol/LH2SO4溶液。可观察到的现象是_______ ;得出的结论是_______ 。
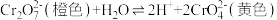 。
。(1)向2mL0.1mol/LK2Cr2O7溶液中滴加5滴6mol/LNaOH溶液。可观察到的现象是
(2)向上述溶液中再滴加10滴6mol/LH2SO4溶液。可观察到的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】乙酸制氢具有重要意义,同时可能发生的反应如下:
热裂解反应: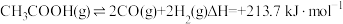
脱羧基反应:
完成下列问题:
(1)乙酸制氢时选择___________ (填“高压”或“常压”)有利于提高转化率。
(2)乙酸制直时温度与气体产率关系如图所示。
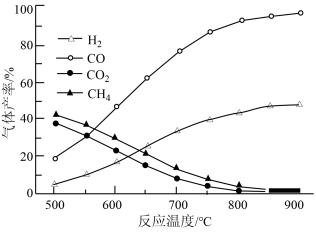
约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且___________ 。
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:___________ 。
热裂解反应:
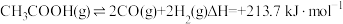
脱羧基反应:

完成下列问题:
(1)乙酸制氢时选择
(2)乙酸制直时温度与气体产率关系如图所示。

约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随若温度升高,热裂解反应速率加快,且
(3)保持其他条件不变,在乙酸气中掺杂一定量水蒸气,氢气产率显著提高而CO的产率下降,请分析原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。Deacon发明的直接氧化法:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:
2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:
(1)该反应平衡常数表达式为_____
(2)下列措施中,能提高中O2转化率的有
(3)恒温恒容时,下列能作为反应达到平衡判据的是_____
A.HCl和O2的转化率之比为4:1 B.气体的压强不变 C.K不变 D.2v正(O2)=v逆(Cl2) E.容器内气体的密度不变 F.容器内气体的平均相对分子质量不变
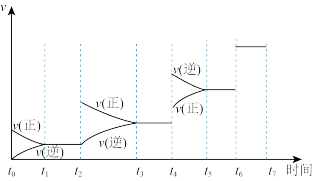
(4)恒容条件下,反应达到平衡后改变某一条件,反应速率(v)与时间(t)的关系如图所示,t4~t5引起变化的原因可能是___________ ; H2O(g)的浓度最高的时间段是___________ ;t6引起变化的原因可能是___________ 。
 2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:
2Cl2(g)+2H2O(g) ∆H <0.回答下列问题:(1)该反应平衡常数表达式为
(2)下列措施中,能提高中O2转化率的有
| A.使用过量HCl | B.升高温度 | C.增大压强 | D.使用催化剂 |
A.HCl和O2的转化率之比为4:1 B.气体的压强不变 C.K不变 D.2v正(O2)=v逆(Cl2) E.容器内气体的密度不变 F.容器内气体的平均相对分子质量不变
(4)恒容条件下,反应达到平衡后改变某一条件,反应速率(v)与时间(t)的关系如图所示,t4~t5引起变化的原因可能是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=______ 。平衡时H2的转化率为______ %。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______ (任写一项)。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示;请完成下列问题:
①试比较K1、K2的大小,K1____ K2(填“<、>、=”)
②400℃时,反应2NH3(g)⇌N2(g)+3H2(g)的化学平衡常数为_____ 。
当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正____ v(N2)逆(填“<、>、=”)。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=
(2)平衡后,若提高H2的转化率,可以采取的措施有
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示;请完成下列问题:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,反应2NH3(g)⇌N2(g)+3H2(g)的化学平衡常数为
当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】利用I2O5消除CO污染的反应为5CO(g)+I2O5(s) 5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题:
5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题:_______ mol•L-1•min-1。
(2)b点时CO的转化率为_____ ,T1温度下该反应的平衡常数K=______ 。
(3)T1______ T2(填“>”或“<”或“=”,下同),b点的平衡常数_______ c点的平衡常数。
(4)反应达到平衡后,保持温度和体积不变再充入一定量的CO气体,则平衡_______ (填“正向”“逆向”或“不”)移动,达到新平衡后CO转化率______ (填“增大”“减小”或“不变”)。
(5)若在T1温度下,起始时改为向装有足量I2O5固体的2L恒容密闭容器中通入3molCO和5molCO2气体,反应达平衡时的能量变化的绝对值为bkJ,则2CO(g)+I2O5(s) 2CO2(g)+I2(s)的△H=
2CO2(g)+I2(s)的△H=______ kJ•mol-1(用含b的代数式表示)。
 5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题:
5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题: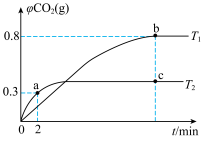
(2)b点时CO的转化率为
(3)T1
(4)反应达到平衡后,保持温度和体积不变再充入一定量的CO气体,则平衡
(5)若在T1温度下,起始时改为向装有足量I2O5固体的2L恒容密闭容器中通入3molCO和5molCO2气体,反应达平衡时的能量变化的绝对值为bkJ,则2CO(g)+I2O5(s)
 2CO2(g)+I2(s)的△H=
2CO2(g)+I2(s)的△H=
您最近一年使用:0次



