下列表述中,合理的是
A.醋酸溶液中加入少量醋酸钠晶体恢复至原温度后溶液的pH、 均增大 均增大 |
B. 水解的离子方程式: 水解的离子方程式: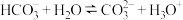 |
C.用惰性电极电解硫酸铝溶液,阴阳两极产生相同状况下等体积的气体,加入 可复原至电解前状态 可复原至电解前状态 |
D.用惰性电极电解足量的 溶液时,当有0.2mol 溶液时,当有0.2mol 转移时会析出21.6g银 转移时会析出21.6g银 |
更新时间:2023-12-20 11:26:17
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】某二元弱酸(简写为H2B)溶液,按下式发生一级和二级电离:
H2B H++HB-
H++HB-
HB- H++B2-
H++B2-
已知相同浓度时的电离度a(H2B)>>a(HB-),现有下列四种溶液:
①0.01mol•L-1的H2B溶液
②0.01mol•L-1的NaHB溶液
③0.02mol•L-1的HCl溶液与0.04mol•L-1的NaHB溶液等体积混合后的溶液
④0.02mol•LL-1的NaOH溶液与0.02mol•L-1的NaHB溶液等体积混合后的溶液
下列说法错误的是( )
H2B
 H++HB-
H++HB-HB-
 H++B2-
H++B2-已知相同浓度时的电离度a(H2B)>>a(HB-),现有下列四种溶液:
①0.01mol•L-1的H2B溶液
②0.01mol•L-1的NaHB溶液
③0.02mol•L-1的HCl溶液与0.04mol•L-1的NaHB溶液等体积混合后的溶液
④0.02mol•LL-1的NaOH溶液与0.02mol•L-1的NaHB溶液等体积混合后的溶液
下列说法错误的是( )
| A.溶液④一定显碱性 | B.c(H2B)最大的是③ |
| C.c(B2-)最小的是① | D.c(H+)最大的是③ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在0.l mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
 CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是| A.加入少量CH3COONa固体,平衡不移动,c(H+)不变 |
| B.加入少量NaOH固体,平衡向正向移动,溶液中c(H+)减小 |
C.加水,平衡向正向移动, 增大 增大 |
| D.通入少量HCl气体,平衡逆向移动,溶液中c(H+)减少 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列反应的离子方程式书写正确的是( )
| A.SO2通入溴水中:SO2+2H2O+Br2=2H++SO42-+2HBr |
| B.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| D.硫化钠的水解反应:S2-+H3O+=HS-+H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列离子方程式与所述事实相符且正确的是
A.NaHS水解反应:HS-+H2O H3O++S2- H3O++S2- |
| B.Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O |
C.Na2CO3水溶液中存在平衡:CO32-+H2O HCO3-+OH- HCO3-+OH- |
D.BaSO4的水溶液导电性极弱:BaSO4 Ba2++SO42- Ba2++SO42- |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列反应的离子方程式正确的是
A.向NaHSO4中滴加少量Ba(HCO3)2溶液: |
B.向有AgCl沉淀的溶液中滴加氨水,沉淀消失: |
C.向FeI2溶液中通入一定量氯气,测得有50%的Fe2+被氧化: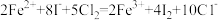 |
D.NaHCO3的水解: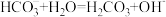 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
| A.CuSO4 | B.Na2SO4 | C.CuCl2 | D.NaCl |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】将等物质的量的 、
、 和
和 溶于水,用石墨作电极电解所得到的溶液。电解一段时间后,相同条件下,测得阴、阳两极产生气体的体积比为
溶于水,用石墨作电极电解所得到的溶液。电解一段时间后,相同条件下,测得阴、阳两极产生气体的体积比为 。下列说法正确的是
。下列说法正确的是
 、
、 和
和 溶于水,用石墨作电极电解所得到的溶液。电解一段时间后,相同条件下,测得阴、阳两极产生气体的体积比为
溶于水,用石墨作电极电解所得到的溶液。电解一段时间后,相同条件下,测得阴、阳两极产生气体的体积比为 。下列说法正确的是
。下列说法正确的是A.阴极的电极反应为 |
B.阳极的电极反应始终为 |
| C.两极共生成三种气体 |
| D.向电解后的溶液中通入适量的HCl可使溶液恢复到电解前的状态 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】冶炼金属一般有下列四种方法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法。四种方法在工业上均有应用,古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是()
| A.(Ⅰ)—① | B.(Ⅱ)—② | C.(Ⅲ)—③ | D.(Ⅳ)—④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下表中金属的冶炼原理与方法完全正确的是
冶炼原理 | 方法 | |
A | CuSO4+2Na=Cu+Na2SO4 | 湿法炼铜 |
B | 2Al2O3 (熔融) | 电解法 |
C | Cu2S+O2 | 热分解法 |
D | 2Ag2O | 热还原法 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次


 增大
增大
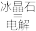 4Al + 3O2↑
4Al + 3O2↑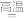 2Cu+SO2
2Cu+SO2 4Ag+O2↑
4Ag+O2↑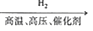 NH3
NH3 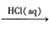 NH4Cl (aq)
NH4Cl (aq)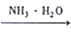 [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) 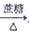 Ag
Ag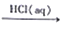 SiCl4
SiCl4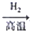 Si
Si Mg
Mg

