 是一种二元弱酸,
是一种二元弱酸, 时其电离平衡常数
时其电离平衡常数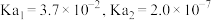 。
。(1)①
 溶液与足量
溶液与足量 溶液反应的离子方程式为
溶液反应的离子方程式为②
 时,向
时,向 的
的 溶液中滴加等浓度等体积的
溶液中滴加等浓度等体积的 溶液(溶液体积变化忽略不计),则溶液中的
溶液(溶液体积变化忽略不计),则溶液中的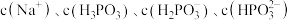 微粒浓度从大到小的排列顺序为
微粒浓度从大到小的排列顺序为(2)某温度下,四种酸在冰醋酸中的电离常数如下表:
| 酸 |  |  |  |  |
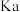 |  | 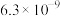 |  | 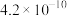 |
| A.用浓硫酸和氯化钠固体加热制氯化氢是因为在水中硫酸的酸性比盐酸的酸性强 |
B.冰醋酸中可以发生反应: |
C.冰醋酸中 的电离方程式为: 的电离方程式为: |
D.向硫酸的冰醋酸溶液中加入 ,硫酸的电离程度增大 ,硫酸的电离程度增大 |
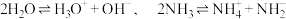
①
 与
与 反应的化学方程式为
反应的化学方程式为②醋酸和氢氟酸在水溶液中为弱酸,但在液氨中都显强酸性的原因可能是
更新时间:2023-12-23 22:40:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】溶液中的化学反应大多是离子反应。请回答下列问题:
(1)已知常温下次氯酸的电离平衡常数为4×10-11,该温度下0.1mol/L的次氯酸溶液的pH为___________ 。(lg2=0.3)
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m___________ n(填“>”“<”或“=”)。
(3)若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)___________ c(CH3COO—)(填“>”“<”或“=”)。
(4)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:___________ (用化学方程式表示);农业上用石膏降低其碱性的反应原理:___________ (用化学方程式表示)。
(5)已知:25 ℃时,0.1 mol·L-1的HA溶液中 =1010。
=1010。
①HA是___________ (填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是___________ (填字母)。
A. B.
B. C.c(H+)与c(OH—)的乘积 D.c(OH—)
C.c(H+)与c(OH—)的乘积 D.c(OH—)
(1)已知常温下次氯酸的电离平衡常数为4×10-11,该温度下0.1mol/L的次氯酸溶液的pH为
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m
(3)若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
(4)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:
(5)已知:25 ℃时,0.1 mol·L-1的HA溶液中
 =1010。
=1010。①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是
A.
 B.
B. C.c(H+)与c(OH—)的乘积 D.c(OH—)
C.c(H+)与c(OH—)的乘积 D.c(OH—)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100 mL 3 mol·L-1的NaOH溶液吸收标准状况下6.72 L SO2时,所得溶液显酸性,溶液中各离子浓度由大到小的顺序为_______________________________________________ 。
(2)常温下,向一定体积的0.1 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是________ 。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
(3)在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
假设溶液混合前后的体积变化忽略不计,则c为________ 。
A.3 B.4 C.5 D.6
(4)常温下,浓度均为0.1 mol·L-1的下列三种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01 mol·L-1的下列三种酸的溶液分别稀释100倍,pH变化最小的是________ 。
A.HCN B.HClO C.CH3COOH
②根据以上数据,判断下列反应可以成立的是________ 。
A.CH3COOH+NaClO=HClO+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.HCN+NaClO=NaCN+HClO
(5)几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,________ (填离子符号)先沉淀,Ksp[Fe(OH)2]________ (填“>”“=”或“<”)Ksp[Mg(OH)2]。
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100 mL 3 mol·L-1的NaOH溶液吸收标准状况下6.72 L SO2时,所得溶液显酸性,溶液中各离子浓度由大到小的顺序为
(2)常温下,向一定体积的0.1 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中
 不变
不变(3)在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
(4)常温下,浓度均为0.1 mol·L-1的下列三种溶液的pH如表所示:
溶质 | CH3COONa | NaClO | NaCN |
pH | 8.8 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol·L-1的下列三种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+NaClO=HClO+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.HCN+NaClO=NaCN+HClO
(5)几种离子开始沉淀时的pH如表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】下表为25℃的三种弱酸的电离平衡常数:
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因_________________________ 。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为_______________ 。
(3)写出NaA溶液中通少量CO2的离子方程式____________________ 。
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:
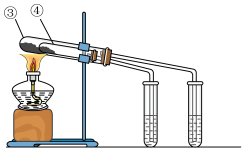
①如上图所示,试管④中装入的固体应该是_________ (填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更_______ (填“强”或“弱”)。
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为
(3)写出NaA溶液中通少量CO2的离子方程式
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:

①如上图所示,试管④中装入的固体应该是
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】25 ℃时,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________ (填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
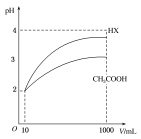
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________ (填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________ (填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________ (填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________ 。(用含“ c、a的代数式表示”)
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】25℃时,四种酸的电离平衡常数如表所示:
回答下列问题:
(1)25℃时,物质的量浓度均为0.1mol/L的下列四种溶液:a. Na2CO3,b. NaClO,c. CH3COONa,d. NaHCO3,pH由大到小 的顺序是___________ (填编号)。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。Na2HPO3是___________ (填“酸式盐”“碱式盐”或“正盐”)。H3PO3的第二级 电离平衡常数表达式K=___________ 。
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:___________ 。
(4)常温下0.1mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据变小的是___________ (填字母)。
A. B.
B.  C.
C. 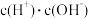 D.
D.  E.
E. 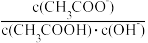
(5)体积均为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程的pH变化如图所示,则相同条件下HX的电离平衡常数___________ 醋酸的电离平衡常数(填“大于”“等于”或“小于”,下同)。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况下的体积大小关系为:CH3COOH___________ HX。

| 化学式 | CH3COOH | HClO | H3PO3 | H2CO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 | 碳酸 |
| 电离平衡常数 | 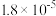 | 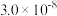 | 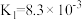 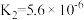 |  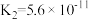 |
(1)25℃时,物质的量浓度均为0.1mol/L的下列四种溶液:a. Na2CO3,b. NaClO,c. CH3COONa,d. NaHCO3,pH
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。Na2HPO3是
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:
(4)常温下0.1mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据变小的是
A.
 B.
B.  C.
C. 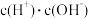 D.
D.  E.
E. 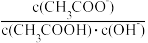
(5)体积均为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程的pH变化如图所示,则相同条件下HX的电离平衡常数

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某学习小组为探究 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。
Ⅰ.配制并测定醋酸溶液中 的浓度。将
的浓度。将 的醋酸溶液进行稀释,并用
的醋酸溶液进行稀释,并用 的NaOH溶液滴定20.00mL稀释后的醋酸溶液。
的NaOH溶液滴定20.00mL稀释后的醋酸溶液。
(1)量取20.00mL醋酸溶液时,用到的仪器为_______ 。
(2)若使用酚酞做指示剂,则滴定终点的判断依据为_______ 。
(3)4次滴定实验所消耗NaOH溶液的体积如下:
计算可知,该醋酸溶液中 的浓度为
的浓度为_______ (计算结果保留4位有效数字)。
Ⅱ.探究浓度对 电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
(4)根据表中数据可以得出 是弱电解质的结论,你认为得出此结论的依据是
是弱电解质的结论,你认为得出此结论的依据是_______ ; 的电离方程式为
的电离方程式为_______ 。
(5)根据表中数据还可以得出另一个结论:随着溶液中 浓度的减小,
浓度的减小, 的电离程度将
的电离程度将_______ (填“增大”“减小”或“不变”)。
(6)由第1组实验数据计算可知,25℃时 的电离常数
的电离常数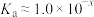 ,则
,则
_______ ;若将等体积、等物质的量浓度的 和
和 溶液混合,所得溶液显酸性,请结合数据解释其原因
溶液混合,所得溶液显酸性,请结合数据解释其原因_______ 。
 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。Ⅰ.配制并测定醋酸溶液中
 的浓度。将
的浓度。将 的醋酸溶液进行稀释,并用
的醋酸溶液进行稀释,并用 的NaOH溶液滴定20.00mL稀释后的醋酸溶液。
的NaOH溶液滴定20.00mL稀释后的醋酸溶液。(1)量取20.00mL醋酸溶液时,用到的仪器为
(2)若使用酚酞做指示剂,则滴定终点的判断依据为
(3)4次滴定实验所消耗NaOH溶液的体积如下:
| 实验次数 | 1 | 2 | 3 | 4 |
| 所消耗NaOH溶液的体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
 的浓度为
的浓度为Ⅱ.探究浓度对
 电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:| 组别 | 1 | 2 | 3 | 4 | 5 |
浓度/( ) ) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
 是弱电解质的结论,你认为得出此结论的依据是
是弱电解质的结论,你认为得出此结论的依据是 的电离方程式为
的电离方程式为(5)根据表中数据还可以得出另一个结论:随着溶液中
 浓度的减小,
浓度的减小, 的电离程度将
的电离程度将(6)由第1组实验数据计算可知,25℃时
 的电离常数
的电离常数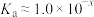 ,则
,则
 和
和 溶液混合,所得溶液显酸性,请结合数据解释其原因
溶液混合,所得溶液显酸性,请结合数据解释其原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2= 4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
I.(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(2)常温下将20 mL 0.4 mol/L的KOH溶液与20 mL 0.2 mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为____________ 。
(3)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液20 mL,能否产生沉淀_____ (填“能”或“不能”).
II .实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)高锰酸钾溶液常用_________ (填“稀硫酸”、“稀硝酸”、“稀盐酸”)酸化,写出滴定过程中发生反应的离子方程式______________ 。
(2)滴定过程中操作滴定管的图示正确的是________ (填编号)。

(3)判断滴定终点的方法是:_____________ 。
(4)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度_____ (填“偏高”或“偏低”或“不变”)。
I.(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将20 mL 0.4 mol/L的KOH溶液与20 mL 0.2 mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液20 mL,能否产生沉淀
II .实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)高锰酸钾溶液常用
(2)滴定过程中操作滴定管的图示正确的是

(3)判断滴定终点的方法是:
(4)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是___________ (填序号)
(2)浓度均为0.1mol/L①NH4Cl ②CH3COONH4 ③NH4HSO4 ④氨水 ⑤(NH4)2SO4 五种溶液中,c(NH )由大到小的顺序
)由大到小的顺序___________ (填序号)。
(3)NaClO溶液中的质子守恒关系为___________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为___________
(5)常温下,0.1mol/L的HClO溶液和0.1mol/L的NaClO溶液等体积混合,判断混合溶液的酸碱性___________ (填“酸性”“碱性”“中性”)
(6)25℃时,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完后溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=___________ 。
(7)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___________ 。
(8)室温下,pH=10的NaOH溶液和pH=10的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于___________
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是
(2)浓度均为0.1mol/L①NH4Cl ②CH3COONH4 ③NH4HSO4 ④氨水 ⑤(NH4)2SO4 五种溶液中,c(NH
 )由大到小的顺序
)由大到小的顺序(3)NaClO溶液中的质子守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,0.1mol/L的HClO溶液和0.1mol/L的NaClO溶液等体积混合,判断混合溶液的酸碱性
(6)25℃时,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完后溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=(7)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(8)室温下,pH=10的NaOH溶液和pH=10的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于
您最近一年使用:0次
【推荐3】按要求填空:
I.
(1)AlCl3的水溶液pH_______ 7 ( 填>、=、<),其原因为_______ (用离子方程式表示),将其溶液加热蒸干并灼烧最终得到的物质是_______ (填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp= c(Cr3+)∙c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______ 。
(3)物质的量浓度相同的三种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4,c( )大小顺序是
)大小顺序是_______ (用序号表示)
(4)常温下两种溶液:a.pH=4的NH4Cl b.pH=4的盐酸,其中水电离出的c(H+)之比为_______ 。
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol/LHA溶液中逐滴加入0.1000mol/L的标准KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
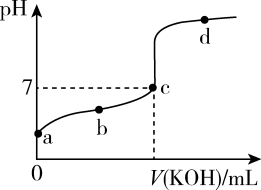
(5)a、b、c、d四点中水的电离程度最大的是_______ 点,滴定过程中宜选用_______ 作指示剂,滴定终点在_______  填“c点以上”或“c点以下”
填“c点以上”或“c点以下” 。
。
(6)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_______。
(7)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_______ mol/L。 保留
保留 位有效数字
位有效数字
I.
(1)AlCl3的水溶液pH
(2)常温下,Cr(OH)3的溶度积Ksp= c(Cr3+)∙c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
(3)物质的量浓度相同的三种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4,c(
 )大小顺序是
)大小顺序是(4)常温下两种溶液:a.pH=4的NH4Cl b.pH=4的盐酸,其中水电离出的c(H+)之比为
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol/LHA溶液中逐滴加入0.1000mol/L的标准KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(5)a、b、c、d四点中水的电离程度最大的是
 填“c点以上”或“c点以下”
填“c点以上”或“c点以下” 。
。(6)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_______。
| A.滴定前碱式滴定管未用标准KOH溶液润洗 |
| B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定 |
| C.滴定过程中,溶液出现变色后,立即停止滴定 |
| D.滴定结束后,仰视液面,读取KOH溶液体积 |
 保留
保留 位有效数字
位有效数字
| 实验序号 | KOH溶液体积/mL | 待测HA溶液体积/mL |
 | 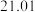 |  |
 | 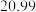 |  |
 | 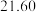 |  |
您最近一年使用:0次



