完成下列问题。
(1)NH4Cl溶液呈________ (填“酸”、“中”、“碱”)性,其原因是(用离子方程式表示) ________ 。
(2)在25℃下,向浓度均为0.1mol•L﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______ 沉淀(填化学式)。{已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11,Ksp[Cu(OH)2]=2.2×10﹣20}
(3)在25℃下,将amol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl﹣),则溶液显_____ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=______ 。
(1)NH4Cl溶液呈
(2)在25℃下,向浓度均为0.1mol•L﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(3)在25℃下,将amol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl﹣),则溶液显
更新时间:2024-01-17 14:41:28
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】25℃时,有浓度均为0.10mol/L的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COOH溶液 ④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是_____ (填序号),其中②由水电离的H+浓度为_____ 。
(2)①中各离子浓度由大到小的顺序是______ 。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为______ .
(3)测得HCN和NaCN的混合溶液的PH=11,,则 约为
约为____ (保留1位有效数字)。
(4)CH3COOH和CH3COONa混合溶液中,若溶液pH=6则溶液中c(CH3COO-) -c(Na+)=___ mol/L(填精确值)。
①NaCN溶液②NaOH溶液③CH3COOH溶液 ④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10mol/L | Ka1=4×10-7mol/L Ka2=5.6×10-11mol/L | Ka=1.7×10-5mol/L |
(1)这4种溶液pH由大到小的顺序是
(2)①中各离子浓度由大到小的顺序是
(3)测得HCN和NaCN的混合溶液的PH=11,,则
 约为
约为(4)CH3COOH和CH3COONa混合溶液中,若溶液pH=6则溶液中c(CH3COO-) -c(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】完成下列问题。
(1) 常作食品加工中的食品添加剂,用于焙烤食品;
常作食品加工中的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。
在分析试剂、医药、电子工业中用途广泛。

①几种均为0.1mol/L的电解质溶液的pH随温度变化的曲线如图甲所示。其中符合 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是___________ (填罗马数字),导致 溶液的pH随温度变化的原因是
溶液的pH随温度变化的原因是___________ 。
②20℃时, 溶液中
溶液中
___________  。
。
(2)下列图象能说明醋酸钠的水解反应达到平衡的是___________ (填标号)。
(3)常温下磷酸和氢氧化钠溶液反应获得含磷各物种的分布分数与pH的关系如图所示。由图分析:
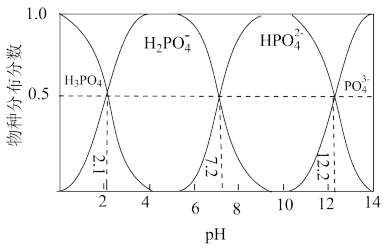
 的
的
_______ ;利用图中数据计算推测 溶液的酸碱性
溶液的酸碱性_______ (写出推理过程和结论)。
(4)室温时,向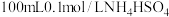 溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。
溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点。在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。
(1)
 常作食品加工中的食品添加剂,用于焙烤食品;
常作食品加工中的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。
在分析试剂、医药、电子工业中用途广泛。
①几种均为0.1mol/L的电解质溶液的pH随温度变化的曲线如图甲所示。其中符合
 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是 溶液的pH随温度变化的原因是
溶液的pH随温度变化的原因是②20℃时,
 溶液中
溶液中
 。
。(2)下列图象能说明醋酸钠的水解反应达到平衡的是
A.溶液中 与反应时间t的关系 与反应时间t的关系 | B. 的水解速率与反应时间t的关系 的水解速率与反应时间t的关系 | C.溶液的pH与反应时间t的关系 | D. 与反应时间t的关系 与反应时间t的关系 |
 |  |  |  |
(3)常温下磷酸和氢氧化钠溶液反应获得含磷各物种的分布分数与pH的关系如图所示。由图分析:

 的
的
 溶液的酸碱性
溶液的酸碱性(4)室温时,向
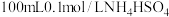 溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。
溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】水是生命的源泉、工业的血液、城市的血脉。要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=________ mol·L-1。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为____________________ ,由水电离出的c(OH-)=________ mol·L-1。
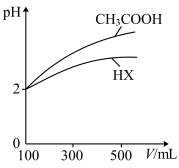
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________ (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________ (用化学式表示)。

(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
| 化学式 | 电离常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知25℃,几种弱酸的电离平衡常数如下表,回答下列问题:
(1)NaHCO3溶液显_______ (填“酸性”“中性”或“碱性”),理由是_____ 。
(2)如图为某实验测得0.1mol·L-1NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是

(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_______ (填“向左”“向右”或“不”)移动。试计算所得溶液中 =
=_______ 。
(4)0.010 mol·L-1的二元酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH变化如图所示。H2A分两步发生电离,对应的电离平衡常数分别为Ka1和Ka2,由图确定下列数据(保留一位小数):

①Ka2=_______ 。
②将0.020 mol·L-1 Na2A溶液和0.010 mol·L-1盐酸等体积混合,所得溶液的pH约为_______ 。
| 酸 | H2CO3 | H2SO3 | H2A |
| Ka | Ka1=4.0×10-7 Ka2=5.0×10-11 | Ka1=1.0×10-2 Ka2=6.0×10-8 | Ka1 Ka2 |
(2)如图为某实验测得0.1mol·L-1NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是

| A.a点溶液的c(OH-)比c点溶液的小 |
| B.a点时,Kw<Ka1(H2CO3)·Ka2(H2CO3) |
C.b点溶液中,c(Na+)=c(HCO )+2c(CO )+2c(CO ) ) |
D.ab段,pH减小说明升温抑制了HCO 的水解 的水解 |
 =
=(4)0.010 mol·L-1的二元酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH变化如图所示。H2A分两步发生电离,对应的电离平衡常数分别为Ka1和Ka2,由图确定下列数据(保留一位小数):

①Ka2=
②将0.020 mol·L-1 Na2A溶液和0.010 mol·L-1盐酸等体积混合,所得溶液的pH约为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L  溶液中,
溶液中,
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②将少量 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是_______ 。
③室温下,一定浓度的 溶液pH=9,用离子方程式表示溶液呈碱性的原因是
溶液pH=9,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中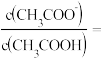
_______ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
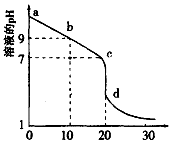
① d点所示的溶液中四种离子浓度由大到小的顺序依次为_______ (用“>”表示)。
② b点所示的溶液中c( )-c(
)-c( )=
)=_______ (用溶液中的其它离子浓度表示)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 |  | HCN |  |
| 电离常数(25℃) |  | 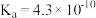 | 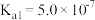  |
 溶液中,
溶液中,
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②将少量
 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是③室温下,一定浓度的
 溶液pH=9,用离子方程式表示溶液呈碱性的原因是
溶液pH=9,用离子方程式表示溶液呈碱性的原因是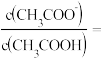
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

① d点所示的溶液中四种离子浓度由大到小的顺序依次为
② b点所示的溶液中c(
 )-c(
)-c( )=
)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】水的离子积常数Kw与温度t(℃)的关系如图所示:
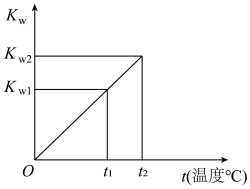
(1)若t1=25℃,则Kw1=_______ ;若t2=100℃时,Kw2=10-12,则此时0.05 mol·L-1的Ba(OH)2溶液的pH=______ ,此时溶液中水电离出的c(OH-)水=________ mol·L-1
(2)已知25℃时,0.1 L0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:_______ 。溶液中各离子的物质的量浓度由大到小的顺序为:_______ 。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为______ 。

(1)若t1=25℃,则Kw1=
(2)已知25℃时,0.1 L0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:

①用NaOH溶液滴定醋酸溶液的曲线是__________________ (填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________ 溶液(填化学式);
③图中V1和V2大小的比较:V1_____ V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______ >______ >______ >________ (用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________ (用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________ (至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________ 。
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:

①用NaOH溶液滴定醋酸溶液的曲线是
②实验前,上述三种溶液中由水电离出的c(H+)最大的是
③图中V1和V2大小的比较:V1
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
操作步骤 | 现象 |
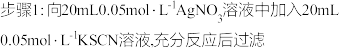 | 出现白色沉沉 |
| 步骤2:向滤液中滴加少量2mol·L-1 Fe(NO3) 3溶液 | 溶液变红色。 |
步骤3: 向步骤2所得溶液中, 加入少量  溶液 溶液 | 现象a |
步骤4 : 取步骤1所得少量滤渣加入到适量的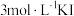 溶液中 溶液中 | 出现黄色沉淀 |
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为
③写出步骤4中沉淀转化反应平衡常数的表达式:K=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】工业通过处理废旧钴酸锂电池正极材料(主要成分为LiCoO2,含少量金属Cu等)回收Co和Li.沉钴,回收Co(OH)2时,向0.100 mol·L-1 CoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀。继续滴加NaOH溶液至pH=___________ 时,Co2+沉淀完全[c(Co2+)≤10-5 mol·L-1]。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知20℃时:K(C6H5OH)=1.2×10-10、K(CH3COOH)=1.8×10-5、K(H2CO3)=4.3×10-7、K(HCO3-)=5.6×10-11、K(HCN)=4.9×10-10。
(1)请根据上述信息求Na2CO3+C6H5OH NaHCO3+C6H5ONa的化学平衡常数K=
NaHCO3+C6H5ONa的化学平衡常数K=__________ ;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol•L-1,则该电解质可能是_________ (填序号);
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。①浓度为1.0×l0-3mol·L-1的氨水b L;②c(OH-)=1.0×10-3mol·L-1的氨水c L;③c(OH-)=1.0×10-3mol•L-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是_________ ;
(4)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的pH=4,则所得溶液中各离子 浓度大小关系是________________ ,所得溶液中的物料守恒式为:________ +________ =__________ =_________ mol•L-1,所得溶液中c(CH3COOH)=____________________ mol•L-1(写出算式,不做计算);
(5)已知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则c(Ag+)=_______________ ,此时所得混合溶液的pH=_____ 。
(1)请根据上述信息求Na2CO3+C6H5OH
 NaHCO3+C6H5ONa的化学平衡常数K=
NaHCO3+C6H5ONa的化学平衡常数K=(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol•L-1,则该电解质可能是
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。①浓度为1.0×l0-3mol·L-1的氨水b L;②c(OH-)=1.0×10-3mol·L-1的氨水c L;③c(OH-)=1.0×10-3mol•L-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是
(4)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的pH=4,则所得溶液中各
(5)已知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则c(Ag+)=
您最近一年使用:0次



