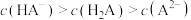下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+) > c(Cl-) > c(OH-) > c(H+) |
13-14高三上·广东潮州·期末 查看更多[2]
更新时间:2016-12-09 06:05:47
|
相似题推荐
多选题
|
适中
(0.65)
【推荐1】常温下,向20.00mL0.1000mol•L-1的NH3•H2O溶液中滴加0.1000mol•L-1的盐酸,溶液中lg 随pH的变化关系如图所示。下列说法不正确的是
随pH的变化关系如图所示。下列说法不正确的是

 随pH的变化关系如图所示。下列说法不正确的是
随pH的变化关系如图所示。下列说法不正确的是
| A.常温下,NH3•H2O电离常数为10-4.75 |
| B.当溶液的pH=7时,消耗盐酸的体积等于20mL |
| C.溶液中水的电离程度:b>c |
D.c点溶液中:c(NH )>c(Cl-) )>c(Cl-) |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐2】下列说法不正确的是
| A.将稀硫酸加热至 90℃(忽略溶液体积变化),其 pH 不变 |
| B.pH 与体积都相等的氨水和 NaOH 溶液分别用 0.1 mol·L-1 的盐酸恰好中和,所需的盐酸体积前者等于后者 |
| C.为配制 c(NH4+ ):c(Cl-)=1:1 的溶液,可在氯化铵溶液中加入适量盐酸 |
| D.在 NaHCO3溶液中,几种微粒浓度的关系:c(Na+)>c(HCO3-)>c(H2CO3 )>c(CO32-) |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
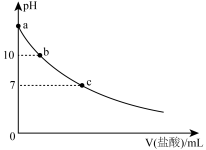
【推荐1】常温下,向 溶液中滴加
溶液中滴加 的盐酸,混合溶液的pH与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下
的盐酸,混合溶液的pH与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下 的电离平衡常数:
的电离平衡常数: 、
、 ,忽略混合溶液体积和温度的变化)
,忽略混合溶液体积和温度的变化)
 溶液中滴加
溶液中滴加 的盐酸,混合溶液的pH与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下
的盐酸,混合溶液的pH与所加盐酸的体积的关系如图所示,下列说法正确的是(已知,常温下 的电离平衡常数:
的电离平衡常数: 、
、 ,忽略混合溶液体积和温度的变化)
,忽略混合溶液体积和温度的变化)
| A.a点对应的pH为13 | B.b点溶液中,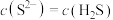 |
| C.c点溶液中,共含有8种不同的微粒 | D.a→c的过程中,溶液中水的电离程度一直增大 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】部分弱酸的电离常数如下表所示:
下列选项错误的是
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25°C) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A.2CN-+H2O+CO2=2HCN+ |
B.25℃时,amol·L-1的HCOOH溶液与bmol·L-1的NaOH溶液等体积混合后溶液呈中性,则a>b且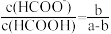 |
| C.中和等体积、等c(H+)的HCN溶液和HCOOH溶液消耗NaOH的量前者大于后者 |
| D.HCN溶液加水稀释后,溶液中所有离子的浓度均减少 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐1】H2C2O4为二元弱酸,20℃时,配制一组 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
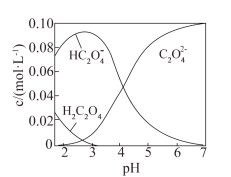
 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=2.5的溶液中: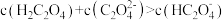 |
B.pH=7的溶液中, |
C. 的溶液中: 的溶液中: |
D. mol·L-1的溶液中: mol·L-1的溶液中: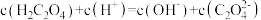 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】向AgBr饱和溶液(有足量AgBr固体)中滴加 溶液,发生反应
溶液,发生反应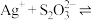
 和
和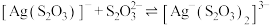 ,pM、pN与
,pM、pN与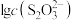 的关系如图所示。其中M代表
的关系如图所示。其中M代表 或
或 ,N代表
,N代表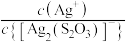 或
或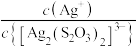 ,
,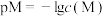 。下列说法错误的是
。下列说法错误的是
 溶液,发生反应
溶液,发生反应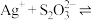
 和
和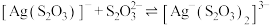 ,pM、pN与
,pM、pN与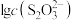 的关系如图所示。其中M代表
的关系如图所示。其中M代表 或
或 ,N代表
,N代表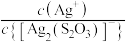 或
或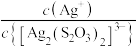 ,
,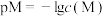 。下列说法错误的是
。下列说法错误的是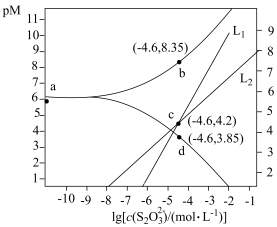
A. 表示 表示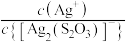 随 随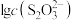 的变化关系 的变化关系 |
B.AgBr的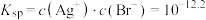 |
C.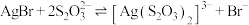 的平衡常数为 的平衡常数为 |
D.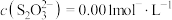 时,溶液中 时,溶液中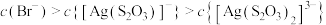 |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐3】下列关系式不正确的是
| A.常温下pH=2的甲酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(HCOO-)> c(OH-) >c(H+) |
| B.0.1mol·L-1Na3PO4溶液中:c(OH-)=c(H+)+c(HPO42-)+2c(H2PO4-)+3c(H3PO4) |
| C.0.4mol·L-1Ba(OH)2溶液与0.3mol·L-1NaHCO3溶液等体积混合:c(OH-)>c(Na+)>c(Ba2+)>c(CO32-) |
| D.1L0.3mol·L-1NaOH溶液吸收标准状态下4.48LCO2:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐1】草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,若溶液体积不变,则对所得溶液中各粒子浓度之间的关系描述正确的是
| A.c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) |
| B.c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L |
| C.c(C2O42-)<c(HC2O4-)<c(H2C2O4) |
| D.c(H+)<c(HC2O4-)<c(C2O42-)<c(K+) |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐2】常温下,向一定浓度 溶液中加入KOH固体,保持溶液体积和温度不变,测得pH与
溶液中加入KOH固体,保持溶液体积和温度不变,测得pH与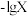 [X为
[X为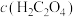 、
、 、
、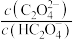 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是

 溶液中加入KOH固体,保持溶液体积和温度不变,测得pH与
溶液中加入KOH固体,保持溶液体积和温度不变,测得pH与 [X为
[X为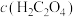 、
、 、
、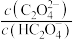 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是
A.曲线M表示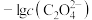 |
B.常温下, |
C.a点溶液中: |
D.b点溶液中: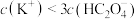 |
您最近一年使用:0次

 。
。
 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是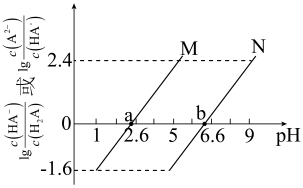
 的关系
的关系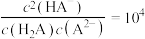
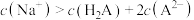
 的溶液中:
的溶液中: