食醋是烹饪美食的调味品,有效成分主要为醋酸. 的应用与其电离平衡密切相关.25℃时,
的应用与其电离平衡密切相关.25℃时, 的
的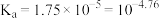 ;
;
(1)用化学用语表示 溶液呈碱性的原因
溶液呈碱性的原因__________________ (用离子方程式表示);
(2)下列方法中,可以使醋酸溶液中 电离程度增大的是___________;
电离程度增大的是___________;
(3)用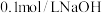 溶液分别滴定体积均为20mL、浓度均为
溶液分别滴定体积均为20mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入
的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入 溶液体积而变化的两条滴定曲线;
溶液体积而变化的两条滴定曲线;
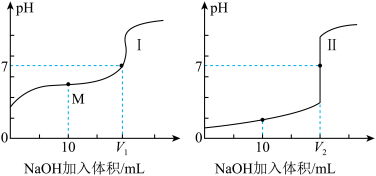
①滴定醋酸的曲线是____________ (填“Ⅰ”或“Ⅱ”);
②在上述滴定过程中,不需要使用的玻璃仪器是___________ (填序号);
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
③图1中M点,溶液中各离子浓度由大到小的顺序是___________ (用符号“c”及“>”表示),此时溶液中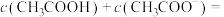
____________ ;(精确到小数点后三位数字)
(4)用 的盐酸滴定20.00mL未知浓度的
的盐酸滴定20.00mL未知浓度的 溶液.下列操作会使测定结果偏低的是___________;
溶液.下列操作会使测定结果偏低的是___________;
 的应用与其电离平衡密切相关.25℃时,
的应用与其电离平衡密切相关.25℃时, 的
的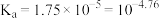 ;
;(1)用化学用语表示
 溶液呈碱性的原因
溶液呈碱性的原因(2)下列方法中,可以使醋酸溶液中
 电离程度增大的是___________;
电离程度增大的是___________;| A.滴加少量浓盐酸 | B.微热溶液 | C.加水稀释 | D.加入少量醋酸钠晶体 |
(3)用
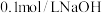 溶液分别滴定体积均为20mL、浓度均为
溶液分别滴定体积均为20mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入
的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入 溶液体积而变化的两条滴定曲线;
溶液体积而变化的两条滴定曲线;
①滴定醋酸的曲线是
②在上述滴定过程中,不需要使用的玻璃仪器是
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
③图1中M点,溶液中各离子浓度由大到小的顺序是
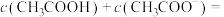
(4)用
 的盐酸滴定20.00mL未知浓度的
的盐酸滴定20.00mL未知浓度的 溶液.下列操作会使测定结果偏低的是___________;
溶液.下列操作会使测定结果偏低的是___________;A.量取 溶液的碱式滴定管未用待测碱液润洗 溶液的碱式滴定管未用待测碱液润洗 |
| B.酸式滴定管未用标准盐酸润洗 |
| C.滴定过程中滴定管内不慎有标准液溅出 |
| D.滴定前俯视读数,滴定后读数正确 |
更新时间:2024-01-23 22:47:56
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】通过下列方法可以测定制备的三氯氧磷 产品中
产品中 元素含量,实验步骤如下:
元素含量,实验步骤如下:
(1)A.取 产品于锥形瓶中,加入足量
产品于锥形瓶中,加入足量 溶液,再加稀硝酸至酸性;
溶液,再加稀硝酸至酸性;
B.向锥形瓶中加入 的
的 溶液
溶液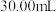 ,使
,使 完全沉淀;
完全沉淀;
C.向其中加入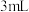 硝基苯,用力摇动,其目的是
硝基苯,用力摇动,其目的是______
D.加入指示剂,用 溶液滴定过量
溶液滴定过量 至终点,记下所用体积
至终点,记下所用体积 。
。
已知: 是白色沉淀,
是白色沉淀,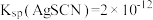 。
。
(2)滴定选用的指示剂是______(填序号)。
 产品中
产品中 元素含量,实验步骤如下:
元素含量,实验步骤如下:(1)A.取
 产品于锥形瓶中,加入足量
产品于锥形瓶中,加入足量 溶液,再加稀硝酸至酸性;
溶液,再加稀硝酸至酸性;B.向锥形瓶中加入
 的
的 溶液
溶液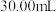 ,使
,使 完全沉淀;
完全沉淀;C.向其中加入
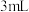 硝基苯,用力摇动,其目的是
硝基苯,用力摇动,其目的是D.加入指示剂,用
 溶液滴定过量
溶液滴定过量 至终点,记下所用体积
至终点,记下所用体积 。
。已知:
 是白色沉淀,
是白色沉淀,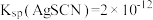 。
。(2)滴定选用的指示剂是______(填序号)。
| A.淀粉 | B.酚酞 | C. | D. |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】某实验小组测定产品中水合肼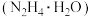 的含量,步骤如下:称取产品
的含量,步骤如下:称取产品 ,加入适量
,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成
保持在6.5左右),加水配成 溶液,移取
溶液,移取 置于锥形瓶中,并滴加2~3滴淀粉溶液,用
置于锥形瓶中,并滴加2~3滴淀粉溶液,用 的碘标准溶液滴定(已知:
的碘标准溶液滴定(已知: )。实验测得消耗碘标准溶液的平均值为
)。实验测得消耗碘标准溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为_______ 。
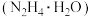 的含量,步骤如下:称取产品
的含量,步骤如下:称取产品 ,加入适量
,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成
保持在6.5左右),加水配成 溶液,移取
溶液,移取 置于锥形瓶中,并滴加2~3滴淀粉溶液,用
置于锥形瓶中,并滴加2~3滴淀粉溶液,用 的碘标准溶液滴定(已知:
的碘标准溶液滴定(已知: )。实验测得消耗碘标准溶液的平均值为
)。实验测得消耗碘标准溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】已知25℃时电离常数:
(1)H2CO3、CH3COOH、HCN三种酸中酸性最弱的是______ 。常温下,pH均为10的Na2CO3、CH3COONa、NaCN、NaHCO3四种溶液中,物质的量浓度最大的是______ ,该溶液由水电离出c(H+)=_______ 。
(2)常温下,向20mL0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

①若想观察滴定终点,滴定过程中宜选用______ 作指示剂(填“酚酞”、“石蕊”或“甲基橙”)。
②b点时,混合溶液显_____ (填“酸性”、“中性”或“碱性”),此时溶液中离子浓度由大到小的顺序是______ 。
(3)常温下,向NaCN溶液中通入少量 CO2发生反应的化学方程式为:______ 。
(4)在一定条件下,Na2CO3溶液中存在CO +H2O
+H2O HCO
HCO +OH-平衡,下列说法正确的是
+OH-平衡,下列说法正确的是______ 。
| 酸 | H2CO3 | CH3COOH | HCN |
| Ka | Ka1=4.5×10-7 Ka2=5.6×10-11 | 1.75×10-5 | 6.2×10-10 |
(2)常温下,向20mL0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

①若想观察滴定终点,滴定过程中宜选用
②b点时,混合溶液显
(3)常温下,向NaCN溶液中通入
(4)在一定条件下,Na2CO3溶液中存在CO
 +H2O
+H2O HCO
HCO +OH-平衡,下列说法正确的是
+OH-平衡,下列说法正确的是A.稀释溶液, 增大 增大 | B.通入CO2,溶液pH减小 |
| C.升高温度,水解平衡常数增大 | D.加入Na2O固体,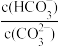 减小 减小 |
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】弱电解质的电离方程式
(1)弱电解质的电离过程是可逆的,其电离方程式用“ ”表示。如:
”表示。如:
CH3COOH:___________ ;
NH3·H2O:___________ 。
(2)多元弱酸是分步电离的,电离程度逐步减弱,可分步书写电离方程式。
如H2CO3的电离方程式:___________ 、___________ 。
(3)多元弱碱的电离也是分步进行的,但是一般按一步电离的形式书写。
如Fe(OH)3的电离方程式是:___________ 。
(1)弱电解质的电离过程是可逆的,其电离方程式用“
 ”表示。如:
”表示。如:CH3COOH:
NH3·H2O:
(2)多元弱酸是分步电离的,电离程度逐步减弱,可分步书写电离方程式。
如H2CO3的电离方程式:
(3)多元弱碱的电离也是分步进行的,但是一般按一步电离的形式书写。
如Fe(OH)3的电离方程式是:
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】(Ⅰ)在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HCl ΔH>0
Fe(OH)3+3HCl ΔH>0
(1)不断加热FeCl3溶液,蒸干其水分并完全灼烧得到的固体是___ 。
(2)在配制FeCl3溶液时,应先把FeCl3固体溶解在___ 中,再加水,其目的是___ 。
(Ⅱ)有两瓶pH均为2的盐酸、醋酸溶液:
(1)设两种溶液的物质的量浓度依次为c1、c2,则其关系是___ (用“>”、“<”或“=”表示,下同)。
(2)完全中和体积和物质的量浓度均相同的两份NaOH溶液时,需两种酸的体积依次为V1、V2,则其关系是___ 。
 Fe(OH)3+3HCl ΔH>0
Fe(OH)3+3HCl ΔH>0(1)不断加热FeCl3溶液,蒸干其水分并完全灼烧得到的固体是
(2)在配制FeCl3溶液时,应先把FeCl3固体溶解在
(Ⅱ)有两瓶pH均为2的盐酸、醋酸溶液:
(1)设两种溶液的物质的量浓度依次为c1、c2,则其关系是
(2)完全中和体积和物质的量浓度均相同的两份NaOH溶液时,需两种酸的体积依次为V1、V2,则其关系是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】请回答下列问题:
(1)某浓度的氨水中存在平衡:NH3·H2O NH
NH +OH-。若增大NH
+OH-。若增大NH 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是___________ (填字母)。
a.加入NH4Cl固体 b.适当升高温度 c.通入NH3 d.加入少量浓盐酸
(2)常温下,c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,醋酸溶液中c(H+)___________ (填“增大”、“减小”或“不变”,下同),盐酸中c(H+)___________ 。
②加水稀释10倍后,醋酸溶液中的c(H+)___________ (填“>”、“=”或“<”)盐酸中的c(H+)。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸___________ (填“>”“=”或“<”)盐酸。
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___________ (填字母)。(①表示盐酸,②表示醋酸)
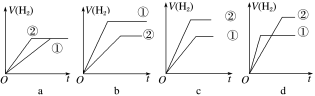
(3)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是___________ (填字母)。
a.电离程度增大 b.溶液中离子浓度都增大 c.Ka(乙酸)不变 d.溶液中醋酸分子减少
(1)某浓度的氨水中存在平衡:NH3·H2O
 NH
NH +OH-。若增大NH
+OH-。若增大NH 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是a.加入NH4Cl固体 b.适当升高温度 c.通入NH3 d.加入少量浓盐酸
(2)常温下,c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,醋酸溶液中c(H+)
②加水稀释10倍后,醋酸溶液中的c(H+)
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

(3)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是
a.电离程度增大 b.溶液中离子浓度都增大 c.Ka(乙酸)不变 d.溶液中醋酸分子减少
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】常温下,有两种溶液:
①0.1mol·L-1CH3COOH溶液
②0.1mol·L-1CH3COONa溶液
(1)溶液①的pH___ (填“>”“<”或“=”)7,溶液中离子的电荷守恒的关系式是___ 。
(2)溶液②呈___ (填“酸”“碱”或“中”)性。溶液中物料守恒的关系式是___ 。
(3)下列说法正确的是___ (填序号)。
a.两种溶液中c(CH3COO-)都等于0.1mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
①0.1mol·L-1CH3COOH溶液
②0.1mol·L-1CH3COONa溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列说法正确的是
a.两种溶液中c(CH3COO-)都等于0.1mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】常温下,实验测得0.1mol·L-1下列物质的溶液pH如表所示:
(1)Na2CO3溶液显碱性的主要原因为____ (用离子方程式表示)。
(2)上述CH3COONH4溶液中c(NH )
)____ NH4Cl溶液中c(NH )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。
(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=____ 。
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:____ 。
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:___ 。
物质 | Na2CO3 | CH3COONa | NaHCO3 | CH3COONH4 | NH4Cl |
溶液pH | 11 | 8.9 | 8.3 | 7.0 | a |
(2)上述CH3COONH4溶液中c(NH
 )
) )(填“大于”“小于”或“等于”)。
)(填“大于”“小于”或“等于”)。(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则a=
(4)推测上述CH3COONa溶液的pH大于NaHCO3溶液pH的可能原因:
(5)锅炉水垢的主要成分里含有CaSO4,去除水垢时经常先用饱和Na2CO3溶液浸泡,后用盐酸溶解。请应用化学平衡移动原理解释清洗CaSO4的过程:
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】水溶液是生命体赖以生存的环境,许多化学反应都是在水溶液中进行的。
I.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)室温下,关于 的
的 溶液,下列分析正确的是
溶液,下列分析正确的是
(2)物质的量浓度均为0.1 的六种溶液①
的六种溶液①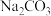 ②
② ③NaClO④
③NaClO④ ⑤
⑤ ⑥
⑥ ,pH由小到大的顺序
,pH由小到大的顺序___________ (填序号)。
(3)向次氯酸钠溶液通入少量 发生反应的离子方程式
发生反应的离子方程式___________ 。
(4)碳酸氢铵溶液显___________ (填“酸”、“中”或“碱”)性。
(5)向a 的
的 溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度
溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度___________  (用含a的式子表示)。
(用含a的式子表示)。
II. 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
(6)则 和水反应的化学方程式为:
和水反应的化学方程式为:___________ 。
(7)若将 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与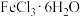 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是___________ 。(用简要的文字回答)
I.25℃时,部分物质的电离平衡常数如表所示:
| 化学式 |  |  |  |  |
| 电离平衡常数 |  |  |   | 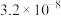 |
请回答下列问题:
(1)室温下,关于
 的
的 溶液,下列分析正确的是
溶液,下列分析正确的是 A.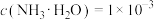  |
B.由水电离出的  |
C.加入少量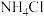 固体, 固体, 的电离平衡逆向移动, 的电离平衡逆向移动, 的值减小 的值减小 |
D.加入等体积 的盐酸,所得溶液: 的盐酸,所得溶液: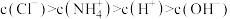 |
 的六种溶液①
的六种溶液①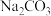 ②
② ③NaClO④
③NaClO④ ⑤
⑤ ⑥
⑥ ,pH由小到大的顺序
,pH由小到大的顺序(3)向次氯酸钠溶液通入少量
 发生反应的离子方程式
发生反应的离子方程式(4)碳酸氢铵溶液显
(5)向a
 的
的 溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度
溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度 (用含a的式子表示)。
(用含a的式子表示)。II.
 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。(6)则
 和水反应的化学方程式为:
和水反应的化学方程式为:(7)若将
 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与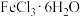 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】滴定法是一种常见的定量实验分析方法,常见的有酸碱中和滴定法、氧化还原滴定法、沉淀滴定法等。常温下,用 的NaOH溶液滴定20.00mL
的NaOH溶液滴定20.00mL 醋酸
醋酸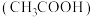 ,滴定曲线如图1所示。
,滴定曲线如图1所示。

1.在上述滴定过程中,不需要使用的玻璃仪器是 。
2.滴定过程中眼睛应注视_____ 。该实验使用的指示剂为_____ ,滴定终点的现象为_____ 。某次实验滴定终点时滴定管中液面位置如图2所示,则此时的读数为_____ mL。
3.如图1所示,c点的纵坐标为7,d点的横坐标为20.00mL,a、b、c、d四个点对应溶液中,_____ 点对应水的电离程度最大,c点溶液中,
_____  (填“>”“<”或“=”)
(填“>”“<”或“=”)
 的NaOH溶液滴定20.00mL
的NaOH溶液滴定20.00mL 醋酸
醋酸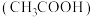 ,滴定曲线如图1所示。
,滴定曲线如图1所示。
1.在上述滴定过程中,不需要使用的玻璃仪器是 。
| A.移液管 | B.滴定管 | C.锥形瓶 | D.胶头滴管 |
3.如图1所示,c点的纵坐标为7,d点的横坐标为20.00mL,a、b、c、d四个点对应溶液中,

 (填“>”“<”或“=”)
(填“>”“<”或“=”)
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】常温下有浓度均为0.5mol/L的五种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O;⑤FeCl3。
(1)上述溶液中,可发生水解的是_______ (填序号,下同)
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液是_______ (填化学式),溶液中离子符合的电荷守恒关系为_______ 。
(3)向溶液④中加入少量氯化铵固体,此时溶液中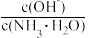 值
值_______ 。(填“增大”、“减小”或“不变”)
(4)⑤可以用来作为净水剂,其原因是(用离子方程式表示)_______ 。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=_______ 。
(6)②和⑤在水中不能大量共存,原因是(用离子方程式表示)_______ 。
(1)上述溶液中,可发生水解的是
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液是
(3)向溶液④中加入少量氯化铵固体,此时溶液中
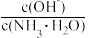 值
值(4)⑤可以用来作为净水剂,其原因是(用离子方程式表示)
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
(6)②和⑤在水中不能大量共存,原因是(用离子方程式表示)
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】回答下列问题
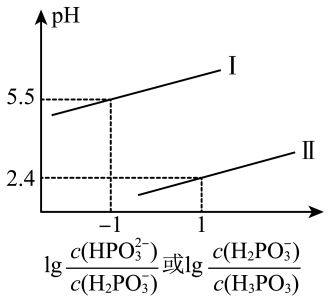
(1)已知亚磷酸(H3PO3)为二元弱酸,则(Na2HPO3)溶液中,各离子浓度的大小关系为_______
(2)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线_______ (填“I”或“II”),亚磷酸(H3PO3)的Kal=_______ 。
(3)常温时,相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH=6,则c(CH3COO-) −c(CH3COOH)=_______ (写出最终计算结果,不能近似计算)
(4)常温时,向100mL0.1 mol∙L−1NH4HSO4溶液中滴加0.1 mol∙L−1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_______ 。
②图中a、b、c、d点中水的电离程度最小的是_______ 。
(5)常温时,若测得HR溶液的pH=a,取该溶液10.0mL,加蒸馏水稀释到100.0mL,测得pH=b,b−a<1,则HR是_______ (选择填入:强酸;弱酸;可能是强酸可能是弱酸)
(1)已知亚磷酸(H3PO3)为二元弱酸,则(Na2HPO3)溶液中,各离子浓度的大小关系为
(2)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示
 的是曲线
的是曲线
(3)常温时,相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH=6,则c(CH3COO-) −c(CH3COOH)=
(4)常温时,向100mL0.1 mol∙L−1NH4HSO4溶液中滴加0.1 mol∙L−1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
②图中a、b、c、d点中水的电离程度最小的是
(5)常温时,若测得HR溶液的pH=a,取该溶液10.0mL,加蒸馏水稀释到100.0mL,测得pH=b,b−a<1,则HR是
您最近一年使用:0次



