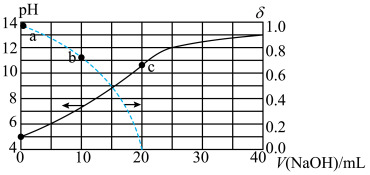
常温时,用 的
的 溶液滴定20.00mL
溶液滴定20.00mL 的
的 溶液。溶液的
溶液。溶液的 、分布系数
、分布系数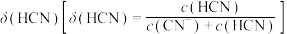 随滴加
随滴加 溶液体积的变化关系如图所示。下列有关说法正确的是
溶液体积的变化关系如图所示。下列有关说法正确的是
 的
的 溶液滴定20.00mL
溶液滴定20.00mL 的
的 溶液。溶液的
溶液。溶液的 、分布系数
、分布系数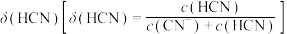 随滴加
随滴加 溶液体积的变化关系如图所示。下列有关说法正确的是
溶液体积的变化关系如图所示。下列有关说法正确的是
A. 酸的 酸的 约为 约为 |
B.b点溶液粒子浓度关系为: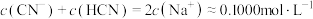 |
C.c点溶液离子浓度关系为: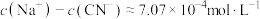 |
D.滴定过程中,水的电离程度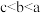 |
更新时间:2024-03-03 21:20:25
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,不考虑混合后溶液体积的变化,下列说法正确的是
| A.0.1mol·L—1CH3COOH溶液加水稀释后,溶液中c(CH3COO—)/c(CH3COOH)的值减少 |
| B.pH=3的CH3COOH溶液和pH=13的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中 CH3COOH的电离度为1% |
| C.a mol·L—1H2C2O4溶液与 a mol·L—1的NaOH溶液等体积混合后,c(C2O42—)>c(HC2O4—)>c(H2C2O4)>C(OH—) |
| D.0.1 mol·L—1的下列溶液中:①NH4A1(SO4)2溶液②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>③>② |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】对于常温下1LpH=1的硝酸溶液,下列叙述正确的是
| A.该溶液lmL稀释至100mL后,pH等于3 |
| B.向该溶液中加入含0.1mol氢氧化钡的溶液恰好完全中和 |
| C.该溶液中硝酸电离出的c(H+)等于水电离出的c(H+) |
| D.该溶液中硝酸电离出的c(H+)是水电离出的c(H+)的100倍 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列实验操作及现象、得出的结论及解释,均正确的是
选项 | 实验操作及现象 | 结论及解释 |
A | 常温下,用胶头滴管将待测NaClO溶液滴在pH试纸上,与标准比色卡对照, | NaClO溶液显碱性 |
B | 在KSCN与 的混合液中再加入少量KCl固体,溶液颜色加深 的混合液中再加入少量KCl固体,溶液颜色加深 | 增大 浓度,平衡正向移动 浓度,平衡正向移动 |
C | 在相同条件下,向一支试管中加入2 mL 5% 溶液,向另一支试管中加入2 mL 5% 溶液,向另一支试管中加入2 mL 5% 溶液和1 mL 溶液和1 mL 溶液,可观察到后者产生气泡速率更快 溶液,可观察到后者产生气泡速率更快 | 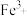 可加快 可加快 分解速率 分解速率 |
D | 在室温下,用pH计分别测定 的 的 溶液、 溶液、 的 的 溶液的pH,前者大于后者 溶液的pH,前者大于后者 | 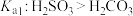 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列实验方案能达到探究目的的是
| 选项 | 探究目的 | 实验方案 |
| A | CO还原 实验中, 实验中, 是否全部被还原 是否全部被还原 | 向CO还原 所得到的产物中加入稀盐酸,再滴加KSCN溶液,观察颜色变化 所得到的产物中加入稀盐酸,再滴加KSCN溶液,观察颜色变化 |
| B | 比较 和 和 结合 结合 的能力大小 的能力大小 | 室温下,用pH计分别测定等物质的量浓度的 溶液和NaClO溶液的pH 溶液和NaClO溶液的pH |
| C | 验证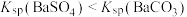 | 将 粉末和 粉末和 饱和溶液混合,充分。振荡,静置,取少量上层清液,滴加盐酸和 饱和溶液混合,充分。振荡,静置,取少量上层清液,滴加盐酸和 溶液,观察是否有沉淀产生 溶液,观察是否有沉淀产生 |
| D | 蔗糖水解产物是否具有还原性 | 向蔗糖溶液中加入少量稀硫酸,加热煮沸,冷却后加入银氨溶液,水浴加热,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某工业废水中Pb2+及其与OH-形成的微粒的浓度分数a随溶液pH变化的关系如图所示。已知NH3·H2O的Kb=1.74×10-5。向Pb(NO3)2溶液中滴加氨水,关于该过程的说法错误的是


A.c(NO )与c(Pb2+)的比值减小后增大,pH>10后不变 )与c(Pb2+)的比值减小后增大,pH>10后不变 |
| B.Pb2+的浓度分数值减小 |
C.pH=7时,存在的阳离子仅有Pb2+、Pb(OH)+、H+以及NH |
D.溶液中Pb2+与Pb(OH)2浓度相等时,氨主要以NH 的形式存在 的形式存在 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.100g质量分数为46%的乙醇水溶液中含有氧原子的数目为NA |
B. 和 和 的固体混合物中阳离子总数为0.1NA 的固体混合物中阳离子总数为0.1NA |
| C.标准状况下,22.4 L CH3Cl中含有的共用电子对数目为4NA |
D.常温下,1L0.1mol/L的氯化铵溶液中滴入氨水至 , , 数目为0.1NA 数目为0.1NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下,浓度均为0.1 mol/L的4种溶液pH如下表:
下列说法正确的是
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
| A.0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少 |
| B.NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C.NaHSO3溶液中:c(Na+)>c(HSO3-) > c(H2SO3)>c(SO32-) > c(H+)>c(OH-) |
| D.向NaClO溶液中滴加硫酸至中性时,2c(SO42-)= c(HClO) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,将0.01 mol·L-1的盐酸逐滴加入到10 mL 0.01 mol·L-1 NaA溶液中。滴加过程中,A-、HA浓度所占分数(δ)随pH变化的关系如图甲所示[其中a点的坐标为(9.5,0.5)],pH变化曲线如图乙所示。下列溶液中的关系一定正确的是
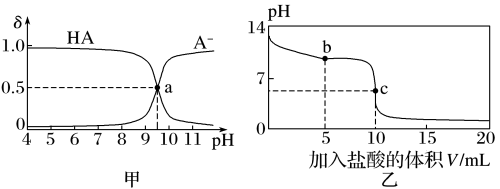

| A.当c(Cl-)=c(HA)时,溶液的pH=7 |
| B.常温下NaA的水解平衡常数:Kh(NaA)=10-9.5 |
| C.b点溶液中阴离子浓度:c(A-)>c(Cl-)>c(OH-) |
| D.c点溶液中:c(A-)+c(HA)=0.0l mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】298 K时,向1 L 0.2 mol·L-1NaH2PO3溶液中通入HCl气体,得到溶液 X;向1 L 0.2 mol﹒L-1NaH2PO3溶液中加入NaOH固体得到溶液Y。溶液pH随加入HCl或NaOH的物质的量的变化关系如图。下列说法正确的是

已知:H3PO3是二元弱酸,298 K 时,Ka1=l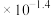 ,Ka2=l
,Ka2=l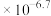 。
。

已知:H3PO3是二元弱酸,298 K 时,Ka1=l
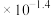 ,Ka2=l
,Ka2=l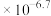 。
。| A.a点溶液的pH<1.4 |
B.d 点溶液中:c(OH-)>c(H2PO )+2c(H3PO3) )+2c(H3PO3) |
C.0.1 mol﹒L-1NaH2PO3溶液中:c( H2PO )>c( H3PO3)>c(H+ )>c(HPO )>c( H3PO3)>c(H+ )>c(HPO ) ) |
D.溶液 X、Y 中都有n(H3PO3)+n(H2PO )+2n(HPO )+2n(HPO )=0.2 mol )=0.2 mol |
您最近一年使用:0次

 的
的 溶液中加入NaOH固体的过程中,部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的关系一定不正确的是
溶液中加入NaOH固体的过程中,部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的关系一定不正确的是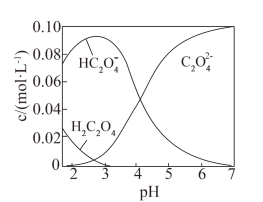
 的溶液中:
的溶液中: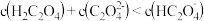
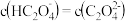 的溶液中:
的溶液中:
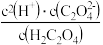 减小
减小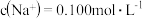 的溶液中:
的溶液中: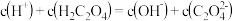
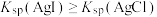
 3H++Y3-
3H++Y3-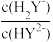 保持不变
保持不变

