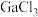 溶液中存在平衡:
溶液中存在平衡: 。常温下,向
。常温下,向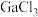 溶液中加入
溶液中加入 溶液,
溶液, 、
、 的浓度分数
的浓度分数 随溶液
随溶液 变化如下图所示。下列说法错误的是
变化如下图所示。下列说法错误的是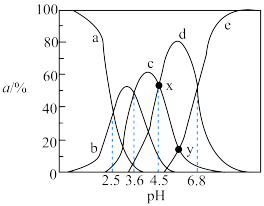
A.曲线 表示 表示 的浓度分数随溶液 的浓度分数随溶液 的变化 的变化 |
B. 点对应的溶液中, 点对应的溶液中,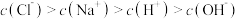 |
C. 点对应的溶液中, 点对应的溶液中, |
D.常温下,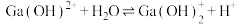 的平衡常数 的平衡常数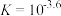 |
更新时间:2024-02-27 22:38:59
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】25℃时,下列说法不正确的是
A.0. 2mol/L NH4HCO3溶液(pH>7): c( )>c( )>c( )>c(H2CO3)>c(NH3·H2O) )>c(H2CO3)>c(NH3·H2O) |
| B.20. 0mL 0. 2mol/L HA溶液中加入10. 0mL 0. 2mol/L KOH溶液后pH=5,则Ka>10-5 |
| C.向0.10mol·L-1 CH3COONa溶液中通HCl至溶液pH=7 (通入气体对溶液体积的影响可忽略): c(Na+) >c( CH3COOH)=c(Cl-) |
D.亚硫酸的电离平衡常数为Ka1 =1.4 ×10-2, Ka2=6.0 ×10-8,向稀KOH溶液中通入SO2至溶液呈中性:c(K+ )>c( )>c( )>c( )>c(OH-) )>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,往某浓度的氯水中滴入Na2S03溶液的pH变化如图所示,下列离子浓度的关系错误的是

| A.a点:c(H+)>c(Cl-)>c(ClO-) |
| B.b点:l/2 c(Cl-)=c(SO42-)=0.005mol·L-1 |
| C.点:c(Na+)=2c(HSO3-)+2c(SO32-) |
| D.d 点:c(Na+)=c(Cl-)+c(HSO3-)+2c(SO32-)+2c(SO42-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】25℃时,在体积均为100 mL、浓度均为0.1 mol·L-1的两种一元酸HA和HB的溶液中,分别加入NaOH固体(温度恢复至室温,溶液体积变化忽略不计), 随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是
随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是

 随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是
随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是
| A.酸性:HA> HB,且HA是强酸,HB是弱酸 |
| B.由水电离出的c(H+ )的顺序:a<b<c<d |
| C.c点溶液中:c(H+)=c(B-)-c(HB) +c(OH-) |
| D.d点溶液中:c(B-)=c(Na+)>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】室温下,甘氨酸在水溶液中主要以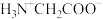 、
、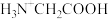 和
和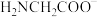 的形式存在,在甘氨酸水溶液中加入
的形式存在,在甘氨酸水溶液中加入 或盐酸调节
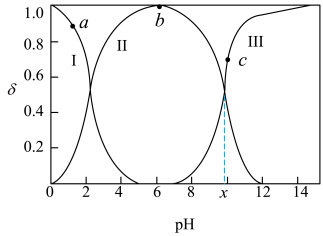
或盐酸调节 ,实验测得甘氨酸溶液中各微粒分布分数
,实验测得甘氨酸溶液中各微粒分布分数 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
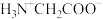 、
、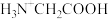 和
和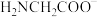 的形式存在,在甘氨酸水溶液中加入
的形式存在,在甘氨酸水溶液中加入 或盐酸调节
或盐酸调节 ,实验测得甘氨酸溶液中各微粒分布分数
,实验测得甘氨酸溶液中各微粒分布分数 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.a点对应溶液中,水的电离程度大于b点 |
B.c点对应溶液中,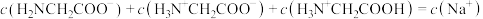 |
C.甘氨酸电离出 的平衡常数 的平衡常数 为 为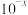 |
D. 点溶液中,存在关系式: 点溶液中,存在关系式: |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,一元碱BOH的Kb(BOH)=1.0×10-5。在某体系中,离子不能穿过隔膜,BOH分子可自由穿过隔膜(如图所示),溶液中c总(BOH)= c(BOH)+c(B+ ),当达到平衡时,下列叙述正确的是


| A.常温下,0.1 mol ·L-1一元碱BOH溶液的pH≈12 |
| B.根据电荷守恒,溶液I和Ⅱ中都存在c(B+ )+c(H+)=c(OH—) |
| C.溶液I和Ⅱ中的c(B+ )相等 |
D.溶液I中BOH的电离度为:  |
您最近一年使用:0次

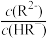 或
或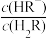 ,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是
,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是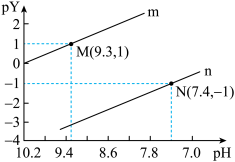
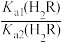 =103.9
=103.9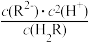 保持不变
保持不变

