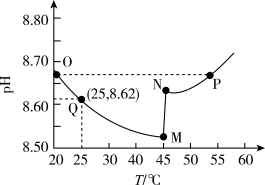
常温下,将一定浓度的氨水逐滴加入
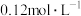
 溶液中,该过程中溶液
溶液中,该过程中溶液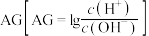 与加入氨水体积V的关系如图所示,已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的
与加入氨水体积V的关系如图所示,已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的 与
与 均约为
均约为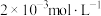 ,下列叙述错误的是
,下列叙述错误的是

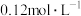
 溶液中,该过程中溶液
溶液中,该过程中溶液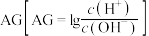 与加入氨水体积V的关系如图所示,已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的
与加入氨水体积V的关系如图所示,已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的 与
与 均约为
均约为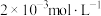 ,下列叙述错误的是
,下列叙述错误的是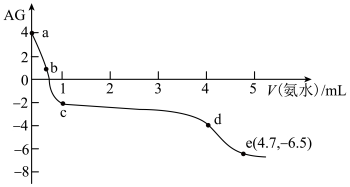
A.a点对应溶液中由水电离出的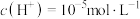 |
B.b点对应溶液中: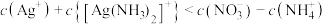 |
C.由e点可知,反应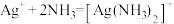 的平衡常数约为 的平衡常数约为 |
| D.最好选择d~e段溶液与葡萄糖等含有醛基的有机物发生银镜反应 |
更新时间:2024-04-24 10:11:12
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,已知电离常数Kb(NH3·H2O)=1.8×10-5; Ka1(H2C2O4)=5.9×10-2, Ka2(H2C2O4)=6.4×10-5。下列说法正确的是
| A.NH4HC2O4溶液中,c(NH4+)= c(HC2O4-) |
| B.用H2C2O4溶液中和氨水至中性时,溶液中c(NH4+)=c(HC2O4-)+2c(C2O42-) |
| C.(NH4)2 C2O4溶液呈酸性,属于酸式盐 |
| D.等物质的量浓度的氨水和H2C2O4溶液等体积混合,所得溶液呈碱性。 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,下列溶液的粒子浓度关系式正确的是
A.0.1 mol/L的NaHCO3溶液中:c(Na+)>c(HCO )>c(CO )>c(CO )>c(H2CO3) )>c(H2CO3) |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a>b+1 |
C.pH=2的H2SO3溶液与pH=12的NaOH溶液等体积混合:c(Na+) +c(H+)=c(OH-) +c(HSO )+2c(SO )+2c(SO ) ) |
| D.0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】设 为阿伏加 德罗常数的值。下列叙述正确的是
为阿伏加 德罗常数的值。下列叙述正确的是
 为阿伏加 德罗常数的值。下列叙述正确的是
为阿伏加 德罗常数的值。下列叙述正确的是A. 难溶于稀硫酸,也难溶于稀醋酸 难溶于稀硫酸,也难溶于稀醋酸 |
B.常温下, 的 的 溶液中的离子总数为 溶液中的离子总数为 |
C.常温下, 的溶液中可能大量存在 的溶液中可能大量存在 、 、 、 、 、 、 |
D.在 稀溶液中, 稀溶液中,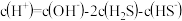 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
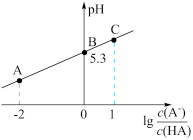
【推荐1】25℃时,在20mL0.1mol•L-1一元弱酸HA溶液中滴加0.1mol•L﹣1NaOH溶液,溶液中1g[ ]与pH关系如图所示。下列说法正确的是
]与pH关系如图所示。下列说法正确的是
 ]与pH关系如图所示。下列说法正确的是
]与pH关系如图所示。下列说法正确的是
| A.B点对应溶液中:c(HA)>c(Na+)>c(H+)>c(OH﹣) |
| B.25℃时,HA酸的电离常数的数量级为10-5 |
C.对C点溶液加热(不考虑挥发),则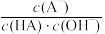 增大 增大 |
| D.B点对应的NaOH溶液体积为10mL |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】 是一元弱酸,与足量的NaOH完全反应后生成
是一元弱酸,与足量的NaOH完全反应后生成 ,下列叙述正确的是
,下列叙述正确的是
 是一元弱酸,与足量的NaOH完全反应后生成
是一元弱酸,与足量的NaOH完全反应后生成 ,下列叙述正确的是
,下列叙述正确的是A. 的溶液显碱性 的溶液显碱性 |
B. 溶液中存在电离平衡: 溶液中存在电离平衡: |
C.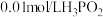 水溶液加水稀,pH增大,所有离子浓度均变小 水溶液加水稀,pH增大,所有离子浓度均变小 |
D. 溶液与NaOH溶液反应的离子方程式为 溶液与NaOH溶液反应的离子方程式为 |
您最近一年使用:0次
【推荐1】某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2.室温下PbCO3和PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc( )或-lgc(I-)的关系如下图所示,且PbCO3更难溶。下列说法正确的是
)或-lgc(I-)的关系如下图所示,且PbCO3更难溶。下列说法正确的是

 )或-lgc(I-)的关系如下图所示,且PbCO3更难溶。下列说法正确的是
)或-lgc(I-)的关系如下图所示,且PbCO3更难溶。下列说法正确的是
| A.Ksp (PbCO3) 为1.0× 10-26.7 |
| B.p点对应的是PbCO3不饱和溶液 |
| C.往PbI2悬浊液中加入Na2CO3溶液,黄色沉淀转变成白色 |
| D.往浓度相同的Na2CO3、NaI 混合溶液中滴入Pb(NO3)2 溶液先产生黄色沉淀 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】现有 由
由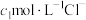 与
与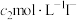 (或由
(或由
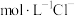 与
与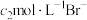 )组成的混合溶液1(或2),分别用
)组成的混合溶液1(或2),分别用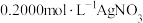 溶液滴定,滴定曲线如图所示。下列说法正确的是
溶液滴定,滴定曲线如图所示。下列说法正确的是
 由
由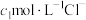 与
与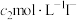 (或由
(或由
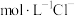 与
与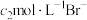 )组成的混合溶液1(或2),分别用
)组成的混合溶液1(或2),分别用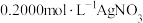 溶液滴定,滴定曲线如图所示。下列说法正确的是
溶液滴定,滴定曲线如图所示。下列说法正确的是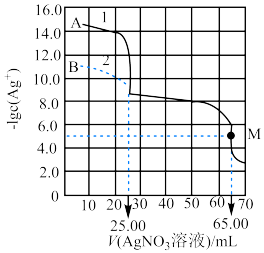
A.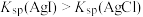 |
B.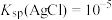 |
C.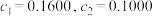 |
D.在 点后继续滴加 点后继续滴加 溶液,溶液 溶液,溶液 中 中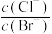 增大 增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】由下列实验操作、现象或事实得出的实验结论错误的是
| 选项 | 实验操作、现象或事实 | 实验结论 |
| A | 向一小块鸡皮上滴加几滴浓硝酸,微热,鸡皮变黄 | 鸡皮中含有蛋白质,浓硝酸可以使蛋白质变黄 |
| B | 往Fe(SCN)₃溶液中加入少量KCl固体,溶液红色变浅 | 溶液中KCl浓度增大,使平衡FeCl₃+3KSCN |
| C | 人体血液中存在H₂CO₃-NaHCO₃体系,当代谢产生的酸进入血液时,pH基本不变 | 当进入H⁺后,H₂CO₃ |
| D | 误服可溶性钡盐后,可以尽快用5%(约为0.35 mol/L)的Na₂SO₄溶液洗胃[Ksp(BaSO₄)=1.1×10⁻10] | 当大量0.35 mol/L的Na₂SO₄溶液进入胃部后,胃中c(Ba²⁺)=3.1×10⁻¹⁰mol/L,Ba²⁺可以充分转化为BaSO₄沉淀,因此可有效地除去胃中的Ba²⁺ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 水解被抑制
水解被抑制 Fe(SCN)₃+3KCl向左移动
Fe(SCN)₃+3KCl向左移动 平衡左移,生成的H₂CO₃分解成CO₂,从肺部呼出
平衡左移,生成的H₂CO₃分解成CO₂,从肺部呼出 

