1.
化学选修:化学与技术随着能源问题的进一步突出,氢能作为一种清洁、高效、安全、可持续的能源,被视为21世纪最具发展潜力的清洁能源,开发氢能已引起各国的高度重视.
1.生产氢气的方式很多,写出工业生产中采用煤为原料制取氢气的化学反应方程式:_______ 。
2.热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

请回答下列问题;
①该循环工艺过程的总反应方程式为__________________ .
②运用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出氢气的目的是__________ 。
3.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4热化学循环制氢的反应可表示为:
2MnFe2O4 2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问地:
① 在反应中MnFe2O4是___________ (填“催化剂”或“中间产物”),若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为_____________ 。
②该热化学循环法制氢尚有不足之处,进一步改进的研究方向是____________ .
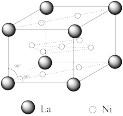
4.氢能的利用涉及氢的储存、运输和使用,镍和镧组成的一种合金LaNiX,是较好的储氢材料,能快速可逆地存储和释放氢气。LaNix的晶胞如右图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=____________ 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixH6+6NiO(OH)  LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:
LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:_______________ 。
化学选修:化学与技术随着能源问题的进一步突出,氢能作为一种清洁、高效、安全、可持续的能源,被视为21世纪最具发展潜力的清洁能源,开发氢能已引起各国的高度重视.
1.生产氢气的方式很多,写出工业生产中采用煤为原料制取氢气的化学反应方程式:
2.热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

请回答下列问题;
①该循环工艺过程的总反应方程式为
②运用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出氢气的目的是
3.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4热化学循环制氢的反应可表示为:
2MnFe2O4
 2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑请认真分析上述两个反应并回答下列问地:
① 在反应中MnFe2O4是
②该热化学循环法制氢尚有不足之处,进一步改进的研究方向是
4.氢能的利用涉及氢的储存、运输和使用,镍和镧组成的一种合金LaNiX,是较好的储氢材料,能快速可逆地存储和释放氢气。LaNix的晶胞如右图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=
 LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:
LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:
更新时间:2016-12-09 14:53:16
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】NO的处理与减排是烟气污染物控制的重点和难点,相关研究引起了国内外的广泛关注。
(1)理论上可采用加热使NO分解的方法处理: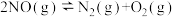 ,反应的部分数据如下表:
,反应的部分数据如下表:
通过计算得出高于7089℃时反应无法自发进行,试判断b____ 0(填“<”、“>”或“=”);反应的平衡常数表达式为____ ;实际反应时发现加热至600℃时NO仍没有明显分解,试解释原因___ 。
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为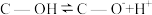 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化: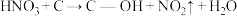
预氧化:
预氧化:
吸附: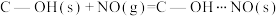
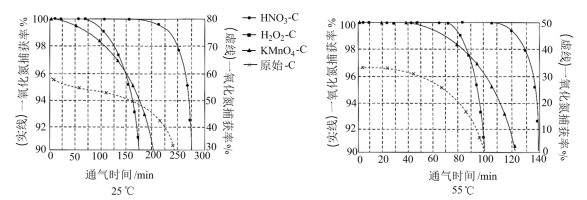
NO吸附实验分别在25℃和55℃下进行,将一定比例的 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
已知:NO捕获率=
请回答:
①下列描述正确的是_______
A.25℃下原始-C在通气约175分钟后吸附效果超过了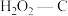
B.若其他条件不变,增大混合气体中 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动
C.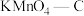 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的
②其他条件不变,55℃下增大烟气中水蒸气含量后,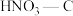 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线____________ 。
③相比其他预氧化试剂处理的活性炭,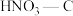 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释_______ 。
(1)理论上可采用加热使NO分解的方法处理:
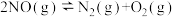 ,反应的部分数据如下表:
,反应的部分数据如下表:项目 |
|
| 正反应活化能 | 逆反应活化能 |
数据/ | a | b | 728 | 910 |
通过计算得出高于7089℃时反应无法自发进行,试判断b
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为
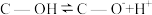 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
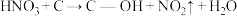
预氧化:

预氧化:

吸附:
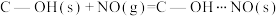
NO吸附实验分别在25℃和55℃下进行,将一定比例的
 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
已知:NO捕获率=

请回答:
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了
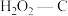
B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动C.
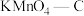 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的

②其他条件不变,55℃下增大烟气中水蒸气含量后,
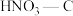 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线③相比其他预氧化试剂处理的活性炭,
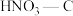 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】实验室研究从医用废感光胶片中回收银的方法。
(1)银的浸出
I.两步法:
已知:i. 溶液与
溶液与 溶液直接混合能发生氧化还原反应;
溶液直接混合能发生氧化还原反应;
ii. ,
,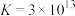 。
。
① 溶液将胶片上的单质银转化为
溶液将胶片上的单质银转化为 ,其离子方程式是
,其离子方程式是_______ 。
② 溶液能溶解
溶液能溶解 并得到含
并得到含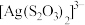 的浸出液。结合平衡移动原理解释
的浸出液。结合平衡移动原理解释 溶解的原因:
溶解的原因:_______ 。
II.一步法:用水溶解 和乙二胺四乙酸二钠(用
和乙二胺四乙酸二钠(用 表示)的混合固体,调节
表示)的混合固体,调节 形成
形成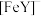 溶液,再加入一定量
溶液,再加入一定量 ,配成浸取液。将废感光胶片浸入浸取液中,发生反应:
,配成浸取液。将废感光胶片浸入浸取液中,发生反应: 。
。
③从物质氧化性或还原性的角度分析加入 的作用:
的作用:_______ 。
(2)银的还原
调节(1)所得浸出液的 ,向其中加入
,向其中加入 溶液(B的化合价为
溶液(B的化合价为 )至不再产生黑色沉淀,过滤得到粗银;滤液中的
)至不再产生黑色沉淀,过滤得到粗银;滤液中的 可以循环使用。补全离子方程式:
可以循环使用。补全离子方程式: ,
,_______ ;
(3)银浸出率的测定
称取m1g洗净干燥的原胶片,灼烧灰化后用 溶解,过滤。滤液用
溶解,过滤。滤液用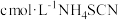 标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗
标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗 标准溶液V2mL。(已知:
标准溶液V2mL。(已知: )
)
①银的浸出率
_______ (列出计算表达式)。
②实验发现在浸取试剂均过量、浸取时间足够长的情况下,与II相比,I中银的浸出率明显偏低,其原因可能是_______ 。
(1)银的浸出
I.两步法:

已知:i.
 溶液与
溶液与 溶液直接混合能发生氧化还原反应;
溶液直接混合能发生氧化还原反应;ii.
 ,
,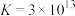 。
。①
 溶液将胶片上的单质银转化为
溶液将胶片上的单质银转化为 ,其离子方程式是
,其离子方程式是②
 溶液能溶解
溶液能溶解 并得到含
并得到含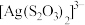 的浸出液。结合平衡移动原理解释
的浸出液。结合平衡移动原理解释 溶解的原因:
溶解的原因:II.一步法:用水溶解
 和乙二胺四乙酸二钠(用
和乙二胺四乙酸二钠(用 表示)的混合固体,调节
表示)的混合固体,调节 形成
形成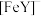 溶液,再加入一定量
溶液,再加入一定量 ,配成浸取液。将废感光胶片浸入浸取液中,发生反应:
,配成浸取液。将废感光胶片浸入浸取液中,发生反应: 。
。③从物质氧化性或还原性的角度分析加入
 的作用:
的作用:(2)银的还原
调节(1)所得浸出液的
 ,向其中加入
,向其中加入 溶液(B的化合价为
溶液(B的化合价为 )至不再产生黑色沉淀,过滤得到粗银;滤液中的
)至不再产生黑色沉淀,过滤得到粗银;滤液中的 可以循环使用。补全离子方程式:
可以循环使用。补全离子方程式: ,
,(3)银浸出率的测定
称取m1g洗净干燥的原胶片,灼烧灰化后用
 溶解,过滤。滤液用
溶解,过滤。滤液用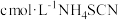 标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗
标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗 标准溶液V2mL。(已知:
标准溶液V2mL。(已知: )
)①银的浸出率

②实验发现在浸取试剂均过量、浸取时间足够长的情况下,与II相比,I中银的浸出率明显偏低,其原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=_____________ 。
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是____________________ (用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________ (填写序号)。

(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是______ 。

 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0(1)请写出上述反应的化学平衡常数表达式:K=
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是
由图2判断,t2到t3的曲线变化的原因可能是
| A.升高温度 | B.加了催化剂 | C.通入O2 | D.缩小容器体积 |

(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。

请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2的标准燃烧△H=______________ 。
(2)上图中循环工艺过程的总反应方程式为__________________________________ 。
(3)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极的电极反应式为
NiO(OH)+MH,电池放电时,负极的电极反应式为____________________________________ 。

请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2的标准燃烧△H=
(2)上图中循环工艺过程的总反应方程式为
(3)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M
 NiO(OH)+MH,电池放电时,负极的电极反应式为
NiO(OH)+MH,电池放电时,负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应: ,正丁烷
,正丁烷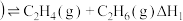
副反应: ,正丁烷
,正丁烷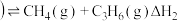
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为 、
、 下几种有机物的生成热:
下几种有机物的生成热:
①表格中的物质,最稳定的是_______  填结构简式
填结构简式 。
。
②上述反应中,
_______ kJ/mol。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_______ (填代号)。
A.气体密度保持不变 B.气体压强保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,下列措施可采用的是_______ (填代号)。
A.加入高效催化剂 B.升高温度 C.充入乙烷 D.减小压强
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是_______(填代号)。

(4)在一定温度下向 恒容密闭容器中充入
恒容密闭容器中充入 正丁烷,反应生成乙烯和乙烷,经过
正丁烷,反应生成乙烯和乙烷,经过 达到平衡状态,测得平衡时气体压强是原来的
达到平衡状态,测得平衡时气体压强是原来的 倍。
倍。
①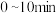 内乙烯的生成速率
内乙烯的生成速率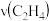 为
为_______ mol·L-1·min-1。
②上述条件下,该反应的平衡常数K为_______ 。
(5)丁烷 空气燃料电池以熔融的
空气燃料电池以熔融的 为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为
为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为_______ 。
主反应:
 ,正丁烷
,正丁烷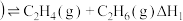
副反应:
 ,正丁烷
,正丁烷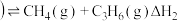
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为
 、
、 下几种有机物的生成热:
下几种有机物的生成热:| 物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热 | 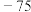 | 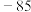 | 52 | 20 |  | 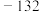 |
 填结构简式
填结构简式 。
。②上述反应中,

(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是
A.气体密度保持不变 B.气体压强保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,下列措施可采用的是
A.加入高效催化剂 B.升高温度 C.充入乙烷 D.减小压强
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是_______(填代号)。

| A.平衡常数降低 | B.活化能降低 | C.催化剂活性降低 | D.副产物增多 |
 恒容密闭容器中充入
恒容密闭容器中充入 正丁烷,反应生成乙烯和乙烷,经过
正丁烷,反应生成乙烯和乙烷,经过 达到平衡状态,测得平衡时气体压强是原来的
达到平衡状态,测得平衡时气体压强是原来的 倍。
倍。①
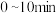 内乙烯的生成速率
内乙烯的生成速率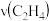 为
为②上述条件下,该反应的平衡常数K为
(5)丁烷
 空气燃料电池以熔融的
空气燃料电池以熔融的 为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为
为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。将一定量的CO2(B)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g) 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1
则反应CO2(g)+CH4(g) 2CO(g) +2H2(g)的△H =
2CO(g) +2H2(g)的△H =___________ 。
(2)其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下,反应经过相同时间时,体系中CO含量随反应温度的变化如图1所示。
①在a点与c点对应的反应条件下,反应继续进行一段时间后达到平衡,平衡常数K(a 点)________ K(c点 )( 填“>”“ <”或“=”)。
②b点CO含量低于c点的原因是____________________ 。
(3)为了探究反应:CO2(g) +CH4(g) 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________ (填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________ (填字母)。

(4)将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=_________ (已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
(5)科学家用氮化镓材料与铜组装成如图3所示的人工光合系统,利用该装置成功地实现了用CO2和H2O合成CH4。。氮化镓(GaN)表面发生__________ (填“氧化”或“还 原”)反应,铜电极上的电极反应式为______________________ 。
 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ·mol-1
CO(g)+
 O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1
则反应CO2(g)+CH4(g)
 2CO(g) +2H2(g)的△H =
2CO(g) +2H2(g)的△H =(2)其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下,反应经过相同时间时,体系中CO含量随反应温度的变化如图1所示。
①在a点与c点对应的反应条件下,反应继续进行一段时间后达到平衡,平衡常数K(a 点)
②b点CO含量低于c点的原因是
(3)为了探究反应:CO2(g) +CH4(g)
 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线
(4)将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应NH4++HCO3-+H2O
 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=(5)科学家用氮化镓材料与铜组装成如图3所示的人工光合系统,利用该装置成功地实现了用CO2和H2O合成CH4。。氮化镓(GaN)表面发生
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】钪(Sc)是一种重要的稀土金属,常用来制特种玻璃、轻质耐高温合金。从“赤泥”矿(主要成分为 、
、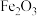 、
、 、
、 )中回收钪,同时生产聚合氯化铁铝[
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:

已知:钪离子可以在不同pH下生成 (n=1~6)。请回答以下问题:
(n=1~6)。请回答以下问题:
(1)基态钪原子的价电子排布式为_______ ,过氧化氢的电子式为_______ 。
(2)“还原”步骤中发生的主要离子反应方程式为_______ 。
(3)“反萃取”时若加入的氢氧化钠大量过量,则生成的含Sc元素的粒子主要为_______ 。
(4)为了使水解步骤反应更加彻底,可以采取的措施为_______ (不能添加化学式剂,任答一条即可)。
(5)步骤X中生成聚合氯化铁铝[ ]的化学反应方程式为
]的化学反应方程式为_______ 。
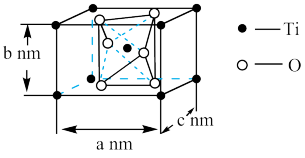
(6)如图是 晶胞的示意图,晶胞中含有的氧原子数目为
晶胞的示意图,晶胞中含有的氧原子数目为_______ 个,已知Ti原子的配位数为6,则O原子的配位数为_______ ,该晶体的密度约为_______  。(NA取
。(NA取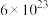 ,结果用含a、b、c的最简分数表达式表示)。
,结果用含a、b、c的最简分数表达式表示)。
 、
、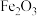 、
、 、
、 )中回收钪,同时生产聚合氯化铁铝[
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:
已知:钪离子可以在不同pH下生成
 (n=1~6)。请回答以下问题:
(n=1~6)。请回答以下问题:(1)基态钪原子的价电子排布式为
(2)“还原”步骤中发生的主要离子反应方程式为
(3)“反萃取”时若加入的氢氧化钠大量过量,则生成的含Sc元素的粒子主要为
(4)为了使水解步骤反应更加彻底,可以采取的措施为
(5)步骤X中生成聚合氯化铁铝[
 ]的化学反应方程式为
]的化学反应方程式为(6)如图是
 晶胞的示意图,晶胞中含有的氧原子数目为
晶胞的示意图,晶胞中含有的氧原子数目为 。(NA取
。(NA取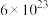 ,结果用含a、b、c的最简分数表达式表示)。
,结果用含a、b、c的最简分数表达式表示)。
您最近一年使用:0次
【推荐2】工业上常用炼钢残渣(主要含FeO•V2O3,还有少量铁粉、SiO2、Al2O3等杂质)为原料提取金属钒,其工艺流程如图所示:

已知:焙烧后铁全部转化为+3价氧化物。
(1)“研磨”的目的是______ ,“磁选”后分离出的X为______ 。
(2)“焙烧”过程中,若转移电子数为2.5NA,则被氧化的FeO•V2O3为______ mol。
(3)“酸浸”时,生成V2O5的离子方程式为______ 。
(4)若“沉钒”前溶液中c(VO )=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH
)=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH )=
)=______ mol•L-1(已知:常温下,Ksp(NH4VO3)=1.6×10-3)。“沉钒”过程中,加入稀H2SO4,其目的是______ 。
(5)检验NH4VO3沉淀是否洗净的操作是______ 。
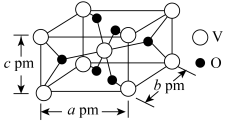
(6)一种含钒的氧化物晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,则该晶体密度为______ g•cm-3 (列出计算式即可)。

已知:焙烧后铁全部转化为+3价氧化物。
(1)“研磨”的目的是
(2)“焙烧”过程中,若转移电子数为2.5NA,则被氧化的FeO•V2O3为
(3)“酸浸”时,生成V2O5的离子方程式为
(4)若“沉钒”前溶液中c(VO
 )=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH
)=0.16mol•L-1,忽略溶液体积变化,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(NH )=
)=(5)检验NH4VO3沉淀是否洗净的操作是
(6)一种含钒的氧化物晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,则该晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铁和钴是两种重要的过渡元素。回答下列问题:
(1)基态 的价电子排布式为
的价电子排布式为_______
(2) 的熔点为306℃,沸点为315℃。
的熔点为306℃,沸点为315℃。 的晶体类型是
的晶体类型是_______ ,实验室可以用KSCN溶液、苯酚(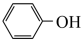 )检验
)检验 。N、O、S的第一电离能由大到小的顺序为
。N、O、S的第一电离能由大到小的顺序为_______ (用元素符号表示), 立体构型为
立体构型为_______ 。
(3)已知冷的浓硫酸和浓硝酸都能使铁表面形成致密的氧化膜,工业上一般用冷的浓硫酸进行钢铁防腐,而不用冷的浓硝酸进行防腐,其可能的原因是_______ 。不同浓度的 与铁反应的还原产物很复杂,写出稀硝酸与过量的铁反应时生成
与铁反应的还原产物很复杂,写出稀硝酸与过量的铁反应时生成 的离子方程式
的离子方程式_______ 。
(4)氧化亚铁晶体的晶胞如下图所示。已知:氧化亚铁晶体的密度为 ,
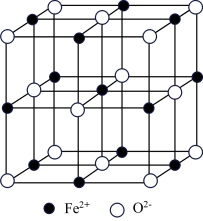
, 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与 紧邻且等距离的
紧邻且等距离的 数目为
数目为_______ ; 与
与 的最短间距为
的最短间距为_______ cm。
(5) 是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量
是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量 溶液,生成白色沉淀2.87 g,则1 mol该配合物的σ键数目为
溶液,生成白色沉淀2.87 g,则1 mol该配合物的σ键数目为_______ 。
(1)基态
 的价电子排布式为
的价电子排布式为(2)
 的熔点为306℃,沸点为315℃。
的熔点为306℃,沸点为315℃。 的晶体类型是
的晶体类型是 )检验
)检验 。N、O、S的第一电离能由大到小的顺序为
。N、O、S的第一电离能由大到小的顺序为 立体构型为
立体构型为(3)已知冷的浓硫酸和浓硝酸都能使铁表面形成致密的氧化膜,工业上一般用冷的浓硫酸进行钢铁防腐,而不用冷的浓硝酸进行防腐,其可能的原因是
 与铁反应的还原产物很复杂,写出稀硝酸与过量的铁反应时生成
与铁反应的还原产物很复杂,写出稀硝酸与过量的铁反应时生成 的离子方程式
的离子方程式(4)氧化亚铁晶体的晶胞如下图所示。已知:氧化亚铁晶体的密度为
 ,
, 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与 紧邻且等距离的
紧邻且等距离的 数目为
数目为 与
与 的最短间距为
的最短间距为
(5)
 是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量
是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量 溶液,生成白色沉淀2.87 g,则1 mol该配合物的σ键数目为
溶液,生成白色沉淀2.87 g,则1 mol该配合物的σ键数目为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】煤和天然气都是重要的化石资源,在工业生产中用途广泛。
(1)燃煤时往往在煤中添加石灰石,目的是___________ ,达到该目的时发生反应的化学方程式为___________ 。
(2)煤的综合利用包括___________ (将煤隔绝空气加强热)、煤的气化和液化。煤的气化是将其转化为可燃性气体的过程,主要发生的反应的化学方程式为___________ 。
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g) CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S___________ (填“>”或“<”)0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为___________ 。
(1)燃煤时往往在煤中添加石灰石,目的是
(2)煤的综合利用包括
(3)CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)
 CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:
CO2(g)+H2(g)△H。 查阅资料得出相关数据如下:| 温度/°C | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】煤是一种重要能源,工业上常把煤进行气化和液化处理,变为清洁能源。由水蒸气和炽热的无烟煤作用可得水煤气,水煤气是混合气体,主要由两种无色无味气体组成,是重要的工业原料。
(1)在工业生产水煤气时,燃料层的温度会下降,这说明____________________________ 。
(2)提出猜想:水煤气的成分可能是 ①______ 和氢气,②________ 和氢气;提出以上猜想的依据是____________ (填元素符号)。
设计实验:请从下列装置中选择一种,设计简单的实验证明猜想。
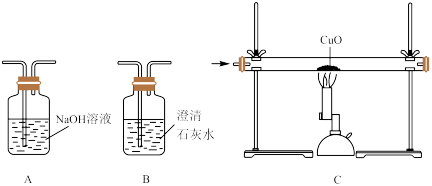
(3)你选择装置是(填字母代号)________ 。
(4)实验结论:如果__________ ,那么猜想_________ (填序号)是合理。
(1)在工业生产水煤气时,燃料层的温度会下降,这说明
(2)提出猜想:水煤气的成分可能是 ①
设计实验:请从下列装置中选择一种,设计简单的实验证明猜想。

(3)你选择装置是(填字母代号)
(4)实验结论:如果
您最近一年使用:0次






