某工厂的废渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,为实现变废为宝,设计了以下工艺流程制备七水硫酸镁。
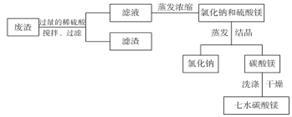
在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为_____________________________ ;
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、 、Cl-,为了除去H+,最好加入适量的
、Cl-,为了除去H+,最好加入适量的_____________________________ (填化学式)。
(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸气并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠____________ (“大”或“小”)。 结晶槽中硫酸镁结晶的方法为_______________ 。
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为____________ 。

在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、
 、Cl-,为了除去H+,最好加入适量的
、Cl-,为了除去H+,最好加入适量的(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸气并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为
2016·海南·一模 查看更多[1]
更新时间:2016-12-09 15:29:28
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡
Ⅰ.已知H2A在水中存在以下平衡:H2A⇌H++HA-,HA-⇌H++A2-
(1)NaHA溶液的pH_______ (填大于、小于或等于) Na2A溶液的pH
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是_______
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) ⇌Ca2+(aq)+A2-(aq) ∆H>0
①降低温度时,Ksp_______ (填“增大”、“减小”或“不变”)
②滴加少量浓盐酸,c(Ca2+)_______ (填“增大”、“减小”或“不变”)
Ⅱ.含有Cr2O 的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O
的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:
Cr2O
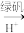 Cr3+、Fe3+
Cr3+、Fe3+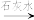 Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(4)该废水中加入绿矾(FeSO4•7H2O)和H+,发生反应的离子方程式为:_______
(5)欲使10L该废水中的Cr2O 完全转化为Cr3+,理论上需要加入
完全转化为Cr3+,理论上需要加入_______ g FeSO4•7H2O
(6)若处理后的废水中残留的c(Fe3+)=2×10-13mol•L-1,则残留的Cr3+的浓度为_______ (已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
Ⅰ.已知H2A在水中存在以下平衡:H2A⇌H++HA-,HA-⇌H++A2-
(1)NaHA溶液的pH
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是_______
| A.c(H+)•c(OH-)=1×10-14 | B.c(Na+)+c(K+)=c(HA-)+2c(A2-) |
| C.c(Na+)>c(K+) | D.c(Na+)+c(K+)=0.05mol/L |
①降低温度时,Ksp
②滴加少量浓盐酸,c(Ca2+)
Ⅱ.含有Cr2O
 的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O
的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理: Cr2O

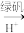 Cr3+、Fe3+
Cr3+、Fe3+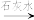 Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3(4)该废水中加入绿矾(FeSO4•7H2O)和H+,发生反应的离子方程式为:
(5)欲使10L该废水中的Cr2O
 完全转化为Cr3+,理论上需要加入
完全转化为Cr3+,理论上需要加入(6)若处理后的废水中残留的c(Fe3+)=2×10-13mol•L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s) +CO2(g)=2Fe3O4(s) +C(s) △Hl =-76.0 kJ·mol-1
ⅱ. C(s) +2H2O(g)=CO2(g) +2H2(g) △H2 = +113.4 kJ·mol-1
(1)3FeO(s) +H2O(g)= Fe3O4(s) +H2(g) △H3 =_________ 。
(2)在反应i中,每放出38.0 kJ热量,有______ g FeO被氧化。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应;测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(3)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
(4)氢气的转化率=________________________ 。
(5)该反应的平衡常数为__________________________ (保留小数点后2位)。
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________ 。
A.升高温度 B.充入He(g),使体系压强增大
C.再充入1 mol H2 D.将H2O(g)从体系中分离出去
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________ c2的关系(填“>”、“<”或“=”)。
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)该吸收液中离子浓度的大小排序为___________________ 。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_________ (填化学式)。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s) +CO2(g)=2Fe3O4(s) +C(s) △Hl =-76.0 kJ·mol-1
ⅱ. C(s) +2H2O(g)=CO2(g) +2H2(g) △H2 = +113.4 kJ·mol-1
(1)3FeO(s) +H2O(g)= Fe3O4(s) +H2(g) △H3 =
(2)在反应i中,每放出38.0 kJ热量,有
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=
(4)氢气的转化率=
(5)该反应的平衡常数为
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.再充入1 mol H2 D.将H2O(g)从体系中分离出去
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)该吸收液中离子浓度的大小排序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚(CH3OCH3)是清洁的燃料和重要的化工原料,具有广泛的应用前景。回答下列问题:
(1)工业上用甲醇制备二甲醚(2CH3OH→CH3OCH3+H2O)分为液相脱水法(已被逐步淘汰)和气相脱水法。液相脱水法是甲醇在浓硫酸作用下加热脱水,该法在实际生产中的主要缺点是_______ 。
(2)我国某科研团队通过计算机模拟技术提出在12-磷钨酸(固体强酸)催化作用下甲醇气相脱水合成二甲醚的反应机理:
CH3OH+H+→IM1(中间体1)→TS1(过渡态1)→IM3(中间体3)→CH +H2O,
+H2O,
CH +CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+
+CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+
反应过程和相对能量E(kJ•mol-1)如图所示。

①该反应机理中的最大能垒(活化能)E正=_______ kJ·mol-1;2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH=
CH3OCH3(g)+H2O(g)ΔH=_______ 。
②IM1为CH2=OH++H2,CH3OH+H+→IM1是一个无垒(活化能为0)过程,可推测该过程_______ (填标号)。
A.从断键开始B.从成键开始C.断键时吸收的能量更多D.成键时释放的能量更多
类似地,IM2为CH2=OH++_______ 。
(3)一定条件下,密闭容器中充入甲醇发生气相脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=
CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=_______ (填含α的代数式);若要进一步提高甲醇的平衡转化率但不改变平衡常数值,可以采取的措施有_______ (答出一条)。
(1)工业上用甲醇制备二甲醚(2CH3OH→CH3OCH3+H2O)分为液相脱水法(已被逐步淘汰)和气相脱水法。液相脱水法是甲醇在浓硫酸作用下加热脱水,该法在实际生产中的主要缺点是
(2)我国某科研团队通过计算机模拟技术提出在12-磷钨酸(固体强酸)催化作用下甲醇气相脱水合成二甲醚的反应机理:
CH3OH+H+→IM1(中间体1)→TS1(过渡态1)→IM3(中间体3)→CH
 +H2O,
+H2O,CH
 +CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+
+CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+反应过程和相对能量E(kJ•mol-1)如图所示。

①该反应机理中的最大能垒(活化能)E正=
 CH3OCH3(g)+H2O(g)ΔH=
CH3OCH3(g)+H2O(g)ΔH=②IM1为CH2=OH++H2,CH3OH+H+→IM1是一个无垒(活化能为0)过程,可推测该过程
A.从断键开始B.从成键开始C.断键时吸收的能量更多D.成键时释放的能量更多
类似地,IM2为CH2=OH++
(3)一定条件下,密闭容器中充入甲醇发生气相脱水反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=
CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
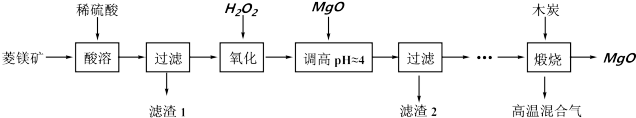
已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为___________ 。
(2)流程中“氧化”的离子方程式为:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O,“氧化”过程中的还原剂为___________ ;还原产物为___________ 。
(3)高温煅烧过程中,同时存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;
MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
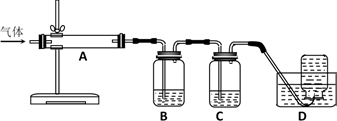
①B中盛放的溶液是酸性KMnO4溶液,发生的离子反应为:(请用单线桥表示电子转移关系)2MnO +5SO2+2H2O= 5SO
+5SO2+2H2O= 5SO +2Mn2+ +4H+
+2Mn2+ +4H+___________ 。
②在清洗A管中沉积S固体时,通常用热的浓NaOH溶液,发生的反应为:(请用双线桥表示电子转移关系)6NaOH+ 3S=2Na2S + Na2SO3 +3H2O,______________ ,在此反应中氧化剂与还原剂的质量之比为___________ 。
③C中盛放的溶液是___________ (填下列选项的字母编号)。
a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.NaCl溶液
④D中收集的气体是___________ (填化学式)。

已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为
(2)流程中“氧化”的离子方程式为:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O,“氧化”过程中的还原剂为
(3)高温煅烧过程中,同时存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;MgSO4+C
 MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;MgSO4+3C
 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。

①B中盛放的溶液是酸性KMnO4溶液,发生的离子反应为:(请用单线桥表示电子转移关系)2MnO
 +5SO2+2H2O= 5SO
+5SO2+2H2O= 5SO +2Mn2+ +4H+
+2Mn2+ +4H+②在清洗A管中沉积S固体时,通常用热的浓NaOH溶液,发生的反应为:(请用双线桥表示电子转移关系)6NaOH+ 3S=2Na2S + Na2SO3 +3H2O,
③C中盛放的溶液是
a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.NaCl溶液
④D中收集的气体是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如图所示:
 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出浸出过程中Co2O3发生反应的离子方程式__________________________ 。
(2)NaClO3的作用是___________________________________ 。
(3)加Na2CO3调pH至5.2所得沉淀为____________________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是_____ ;其使用的适宜pH范围是_____ (填字母)。
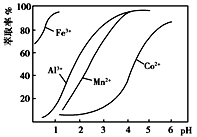
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)NaClO3的作用是
(3)加Na2CO3调pH至5.2所得沉淀为
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】孔雀石是一种古老的玉料,常与其它含铜矿物共生(蓝铜矿、辉铜矿、赤铜矿、自然铜等),主要成分是Cu(OH)2•CuCO3,含少量FeCO3及硅的氧化物。实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
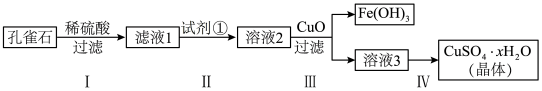
已知:Fe3+在水溶液中存在Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
Fe(OH)3开始沉淀的pH=2.7,沉淀完全的pH=3.7。
(1)为了提高原料的浸出速率,可采取的措施有________ 。
(2)步骤I所得沉淀主要成分的用途为________ 。
(3)步骤Ⅱ中试剂①是____________ (填代号)
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
加入试剂①反应的离子方程式为:________ 。
(4)请设计实验检验溶液3中是否存在Fe3+:___________ 。
(5)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.4500g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6000g。则计算得x=______ (计算结果精确到0.1)。

已知:Fe3+在水溶液中存在Fe3++3H2O
 Fe(OH)3+3H+
Fe(OH)3+3H+Fe(OH)3开始沉淀的pH=2.7,沉淀完全的pH=3.7。
(1)为了提高原料的浸出速率,可采取的措施有
(2)步骤I所得沉淀主要成分的用途为
(3)步骤Ⅱ中试剂①是
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
加入试剂①反应的离子方程式为:
(4)请设计实验检验溶液3中是否存在Fe3+:
(5)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.4500g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6000g。则计算得x=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。
(1)实验室利用下图装置制备氯气。
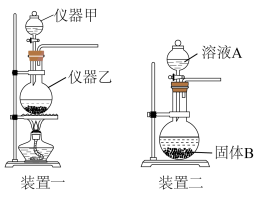
①装置一中仪器甲、乙的名称依次是___________ 、___________ ,写出利用装置一制备氯气的化学方程式:___________ 。
②装置二中溶液A的名称是___________ ,固体B的化学式是___________ 。
(2)利用下图装置制备KClO3和NaClO。

①写出制备KClO3的离子方程式:___________ 。
②实验中使用冰水的目的是___________ 。水浴加热的优点是___________ 。
(3)探究光照条件下次氯酸的分解反应。
①氯水的颜色是浅绿色的,其原因是氯水中含有___________ (填化学式)。
②强光照射氯水时,次氯酸分解,用氯离子传感器采集数据,如图所示:

关于次氯酸的分解反应,你依据图像所得的结论是___________ ,由此你还可以通过推理进一步得出新的结论,新的结论及理由为___________ (写1例)。
(1)实验室利用下图装置制备氯气。

①装置一中仪器甲、乙的名称依次是
②装置二中溶液A的名称是
(2)利用下图装置制备KClO3和NaClO。

①写出制备KClO3的离子方程式:
②实验中使用冰水的目的是
(3)探究光照条件下次氯酸的分解反应。
①氯水的颜色是浅绿色的,其原因是氯水中含有
②强光照射氯水时,次氯酸分解,用氯离子传感器采集数据,如图所示:

关于次氯酸的分解反应,你依据图像所得的结论是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】锆(40Zr)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是ZrSiO4,还含有少量A12O3、SiO2、Fe2O3等杂质)为原料生产锆及其化合物的流程如图所示:

(1)SiCl4的电子式为__________ 。上述流程中,高温气化存在多个反应,若不考虑反应中的损失,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,原因是___________________________________________________ 。
(2)高温气化后的固体残渣除C外,还含有的金属元素有________
(3)写出上述流程中ZrCl4与水反应的化学方程式:_____________________ 。
(4)锆还是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷。下列关于锆、二氧化锆的叙述中,正确的是_____ (填序号)。
a.锆合金比纯锆的熔点高,硬度小
b.二氧化锆陶瓷属于新型无机非金属材料
c.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
d.可采用氦作反应堆包裹核燃料的锆合金的冷却剂
(5)工业上电解K2ZrF6与KCl等组成的熔体也可制取金属锆。写出电解的总反应方程式并标明
电子转移的方向和数目_________________________________________________ 。
(6)某燃料电池是以C2H4作为燃料气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,则负极上发生的反应式为_____________________ 。
(7)极稀溶液中溶质的物质的量浓度很小,常用其负对数pc表示(pcB=-lgcB)。如某溶液中溶质的物质的量浓度为1×10﹣5mol·L﹣1,则该溶液中溶质的pc=5。下列说法正确的是_____

(1)SiCl4的电子式为
(2)高温气化后的固体残渣除C外,还含有的金属元素有
(3)写出上述流程中ZrCl4与水反应的化学方程式:
(4)锆还是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷。下列关于锆、二氧化锆的叙述中,正确的是
a.锆合金比纯锆的熔点高,硬度小
b.二氧化锆陶瓷属于新型无机非金属材料
c.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
d.可采用氦作反应堆包裹核燃料的锆合金的冷却剂
(5)工业上电解K2ZrF6与KCl等组成的熔体也可制取金属锆。写出电解的总反应方程式并标明
电子转移的方向和数目
(6)某燃料电池是以C2H4作为燃料气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,则负极上发生的反应式为
(7)极稀溶液中溶质的物质的量浓度很小,常用其负对数pc表示(pcB=-lgcB)。如某溶液中溶质的物质的量浓度为1×10﹣5mol·L﹣1,则该溶液中溶质的pc=5。下列说法正确的是_____
| A.电解质溶液的pc(H+)与pc(OH-)之和均为14 |
| B.用盐酸滴定某浓度的KOH溶液,滴定过程中pc(H+)逐渐增大 |
| C.BaCl2溶液中逐滴加入硫酸溶液,滴加过程中pc(Ba2+)逐渐减小 |
D.某温度下Ksp(Zr(CO3)2)=4.0×10-12,则其饱和溶液中pc(Zr4+)+pc(CO )=7.7 )=7.7 |
您最近一年使用:0次
【推荐3】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中的电离方程式为________ 。
(2)工业上用a g铝土矿粉(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程如图所示:

已知:
①步骤Ⅰ中焙烧时除了生成三种固体单质外,还可以使固体水分挥发、气孔数目增多,其作用是_________ (要求写出两种),步骤Ⅰ中生成非金属单质的反应的化学方程式为________ 。
②步骤Ⅲ的尾气经冷却至室温后,用足量的NaOH冷溶液吸收,写出吸收过程中发生反应的离子方程式_________ 。
(1)氯化铝在水中的电离方程式为
(2)工业上用a g铝土矿粉(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程如图所示:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1 023 |
①步骤Ⅰ中焙烧时除了生成三种固体单质外,还可以使固体水分挥发、气孔数目增多,其作用是
②步骤Ⅲ的尾气经冷却至室温后,用足量的NaOH冷溶液吸收,写出吸收过程中发生反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:
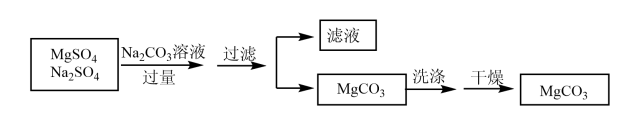
(1)欲证明滤液中存在SO42-、CO32-,选 用的方案是先取少量的滤液滴加过量的
用的方案是先取少量的滤液滴加过量的____ ,发现有气泡生成,再向其中加入_____ 溶液,出现白色沉淀,则可证明SO42-、CO32-均存在。
(2)如何检验MgCO3沉淀是否洗涤干净?____________

(1)欲证明滤液中存在SO42-、CO32-,选
 用的方案是先取少量的滤液滴加过量的
用的方案是先取少量的滤液滴加过量的(2)如何检验MgCO3沉淀是否洗涤干净?
您最近一年使用:0次
【推荐2】磷酸铁(FePO4)常用作电极材料、陶瓷及制药等。以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备磷酸铁的流程如下:
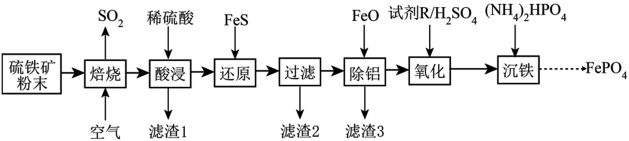
已知几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)“酸浸”需要适当加热,但温度不宜过高,其原因是_____________ 。灼烧滤渣3得到固体的主要成分是__________________ (写出化学式)。
(2)用FeS还原Fe3+的目的是_______________________ 。加入FeO的作用是____________ (用离子方程式表示)。
(3)试剂R宜选择___________ (填字母)。
A.高锰酸钾 B.稀硝酸 C.双氧水 D.次氯酸钠
(4)检验“氧化”之后溶液是否含Fe2+的操作是______________________ 。
(5)纯净磷酸铁呈白色,而实际制备的磷酸铁产品略带棕黄色,可能是产品混有_________ (填化学式)杂质。
(6)常温下,Ksp(FePO4)=1.3×10-22,“沉铁”中为了使c(Fe3+)≤1×10-5 mol·L-1,c(PO43-)最小为__________ mol·L-1。

已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
请回答下列问题:
(1)“酸浸”需要适当加热,但温度不宜过高,其原因是
(2)用FeS还原Fe3+的目的是
(3)试剂R宜选择
A.高锰酸钾 B.稀硝酸 C.双氧水 D.次氯酸钠
(4)检验“氧化”之后溶液是否含Fe2+的操作是
(5)纯净磷酸铁呈白色,而实际制备的磷酸铁产品略带棕黄色,可能是产品混有
(6)常温下,Ksp(FePO4)=1.3×10-22,“沉铁”中为了使c(Fe3+)≤1×10-5 mol·L-1,c(PO43-)最小为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】I.由三种元素组成的难溶化合物 是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究
是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究 的组成(已知
的组成(已知 与稀盐酸恰好完全反应,且溶液
与稀盐酸恰好完全反应,且溶液 与
与 溶液作用显血红色)。
溶液作用显血红色)。
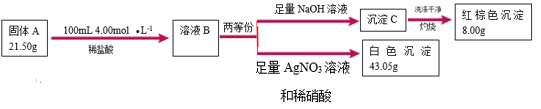
(1) 中非金属元素是
中非金属元素是________ , 的化学式是
的化学式是________ 。
(2)固体 与稀盐酸反应的离子方程式是
与稀盐酸反应的离子方程式是________ 。
(3) 、化合物
、化合物 、有机溶剂(可传导
、有机溶剂(可传导 )组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为
)组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为________ 。
Ⅱ.草酸亚铁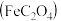 是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性
是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性 溶液,发现
溶液,发现 溶液褪色,说明样品中有二价铁。
溶液褪色,说明样品中有二价铁。
(1)上述实验方案是否科学?说明理由________ 。
(2)请提出改进的实验方案________ 。
 是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究
是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究 的组成(已知
的组成(已知 与稀盐酸恰好完全反应,且溶液
与稀盐酸恰好完全反应,且溶液 与
与 溶液作用显血红色)。
溶液作用显血红色)。 
(1)
 中非金属元素是
中非金属元素是 的化学式是
的化学式是(2)固体
 与稀盐酸反应的离子方程式是
与稀盐酸反应的离子方程式是(3)
 、化合物
、化合物 、有机溶剂(可传导
、有机溶剂(可传导 )组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为
)组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为Ⅱ.草酸亚铁
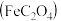 是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性
是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性 溶液,发现
溶液,发现 溶液褪色,说明样品中有二价铁。
溶液褪色,说明样品中有二价铁。(1)上述实验方案是否科学?说明理由
(2)请提出改进的实验方案
您最近一年使用:0次



