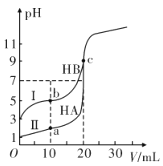
现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
(1)a点时的溶液中由水电离出的c(H+)=________ mol·L-1,Ka(HB)=________ 。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________ ;b点对应的溶液中c(HB)____ c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________ 。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________ c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________ 0.01mol·L-1(填“>”“<”或“=”)。
(1)a点时的溶液中由水电离出的c(H+)=
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)
更新时间:2018-02-06 14:12:16
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1mol/L NaOH溶液滴定10mL0.1mol/L 溶液的滴定曲线如下图所示。
溶液的滴定曲线如下图所示。
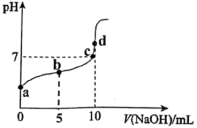
i.下列说法正确的是:_______ (填序号)
①a点溶液的pH=1
②b点溶液中,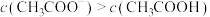
③c点溶液中,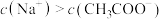
④d点溶液中,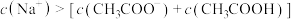
⑤比较a、d两点水的电离程度:a<d
ii.用离子方程式表达d点pH>7的原因:_______ 。
(2)已知:25℃时 、
、 和HClO的电离平衡常数:
和HClO的电离平衡常数:
① 的电离平衡常数表达式
的电离平衡常数表达式
_______ 。
②25℃时,等物质的量浓度的NaClO溶液和 溶液的pH关系为:
溶液的pH关系为: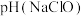
_______ 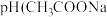 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
③25℃时,若初始时醋酸中 的物质的量浓度为0.01mol/L,达到电离平衡时溶液中
的物质的量浓度为0.01mol/L,达到电离平衡时溶液中
_______ mol/L。(已知: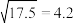 )
)
④下列化学反应能发生的是_______ 。
A.
B.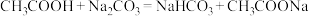
C.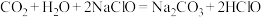
(1)常温下,用0.1mol/L NaOH溶液滴定10mL0.1mol/L
 溶液的滴定曲线如下图所示。
溶液的滴定曲线如下图所示。
i.下列说法正确的是:
①a点溶液的pH=1
②b点溶液中,
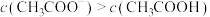
③c点溶液中,
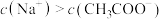
④d点溶液中,
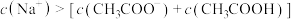
⑤比较a、d两点水的电离程度:a<d
ii.用离子方程式表达d点pH>7的原因:
(2)已知:25℃时
 、
、 和HClO的电离平衡常数:
和HClO的电离平衡常数:| 化学式 |  |  |  |
电离平衡常数( ) ) |  | 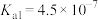  |  |
 的电离平衡常数表达式
的电离平衡常数表达式
②25℃时,等物质的量浓度的NaClO溶液和
 溶液的pH关系为:
溶液的pH关系为: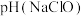
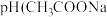 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。③25℃时,若初始时醋酸中
 的物质的量浓度为0.01mol/L,达到电离平衡时溶液中
的物质的量浓度为0.01mol/L,达到电离平衡时溶液中
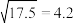 )
)④下列化学反应能发生的是
A.

B.
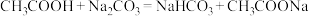
C.
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】国家标准规定,酿造的食醋中醋酸的含量不得低于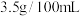 ,即每
,即每 食醋中,折算成的醋酸含量不得低于
食醋中,折算成的醋酸含量不得低于 。选择酚酞作指示剂,用标准
。选择酚酞作指示剂,用标准 溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
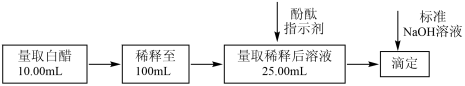
(1)①滴定达到终点时的现象是滴入半滴标准 溶液后
溶液后___________ 。
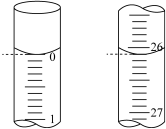
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗 溶液的体积为
溶液的体积为___________  。
。
③已知实验所用标准 溶液的浓度为
溶液的浓度为 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋___________ (填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是___________ (填编号)。
A.碱式滴定管未用标准 溶液润洗就直接注入标准
溶液润洗就直接注入标准 溶液
溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取 溶液体积时,开始时仰视读数,滴定结束时俯视读数
溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中
的盐酸和醋酸溶液,得到滴定过程中 随加入
随加入 溶液体积而变化的两条滴定曲线如图所示。
溶液体积而变化的两条滴定曲线如图所示。
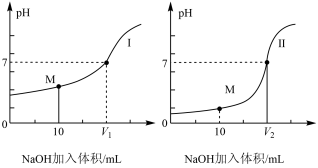
①滴定醋酸的曲线是___________ (填“Ⅰ”或“Ⅱ”)。
②若25℃时, 的醋酸与
的醋酸与 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为___________ (用含a的代数式表示)。
(3)乙二酸 俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向
俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向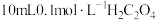 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳微粒的物质的量分数随溶液
溶液,溶液中含碳微粒的物质的量分数随溶液 变化如图所示:
变化如图所示:

①当滴入 溶液的体积为
溶液的体积为 时,混合溶液显
时,混合溶液显___________ 性。(填“酸”“碱”或“中”);
②a点溶液中的
___________ 。
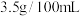 ,即每
,即每 食醋中,折算成的醋酸含量不得低于
食醋中,折算成的醋酸含量不得低于 。选择酚酞作指示剂,用标准
。选择酚酞作指示剂,用标准 溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
(1)①滴定达到终点时的现象是滴入半滴标准
 溶液后
溶液后②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗
 溶液的体积为
溶液的体积为 。
。
③已知实验所用标准
 溶液的浓度为
溶液的浓度为 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准
 溶液润洗就直接注入标准
溶液润洗就直接注入标准 溶液
溶液B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取
 溶液体积时,开始时仰视读数,滴定结束时俯视读数
溶液体积时,开始时仰视读数,滴定结束时俯视读数E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中
的盐酸和醋酸溶液,得到滴定过程中 随加入
随加入 溶液体积而变化的两条滴定曲线如图所示。
溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是
②若25℃时,
 的醋酸与
的醋酸与 的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为(3)乙二酸
 俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向
俗称草酸,在实验研究和化学工业中应用广泛。25℃时,向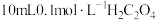 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳微粒的物质的量分数随溶液
溶液,溶液中含碳微粒的物质的量分数随溶液 变化如图所示:
变化如图所示:
①当滴入
 溶液的体积为
溶液的体积为 时,混合溶液显
时,混合溶液显②a点溶液中的

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】完成下列问题。
(1)化学中,酸的电离平衡常数(Ka)是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
①写出HF的电离方程式:_______ 。
②常温下,浓度相同的三种溶液①NaF、②Na2CO3、③CH3COONa,pH由大到小的顺序是_____ 。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是___________ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.100 mol/L的氨水溶液,滴定曲线如图所示(忽略溶液体积的变化,①②填“>”、“<”或“=”)。
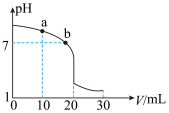
①a点所示的溶液中c(NH3·H2O)_____ c(C1-)。
②b点所示的溶液中c(C1-)_____ c( )。
)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为_____ 。
(1)化学中,酸的电离平衡常数(Ka)是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
| 弱酸 | HF | CH3COOH | H2CO3 | H2S |
| 电离平衡常数 | Ka=7.2×10-4 | Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
②常温下,浓度相同的三种溶液①NaF、②Na2CO3、③CH3COONa,pH由大到小的顺序是
③将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.100 mol/L的氨水溶液,滴定曲线如图所示(忽略溶液体积的变化,①②填“>”、“<”或“=”)。

①a点所示的溶液中c(NH3·H2O)
②b点所示的溶液中c(C1-)
 )。
)。③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】0.2 mol/L CH3COOH溶液和0.1 mol/L NaOH溶液等体积混合,则溶液显_______ ,溶液中离子浓度大小关系是______ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】I.84消毒液在生活中有广泛的应用,其主要成分是NaCl和NaClO。
资料:HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为Ka1=4.3×10-7,Ka2=5.6×10-11;HClO的氧化性和杀菌消毒效果强于ClO-。
84消毒液和医用酒精都是重要的消毒剂。某实验小组同学围绕“84消毒液能否与医用酒精混合使用”这一问题进行了如下实验。
(1)84消毒液溶液呈_______ (填“酸性”或“碱性”)。
(2)实验Ⅲ中应分别取_______ mL 84消毒液和蒸馏水混合均匀。
(3)由实验现象推断,84消毒液和医用酒精_______ (填“能”或“不能”)混合使用。
(4)84消毒液可由氯气与NaOH溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的NaOH,请运用平衡移动原理解释NaOH的作用:( 用离子方程式表示并配以必要的文字说明)_______ 。
II.室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
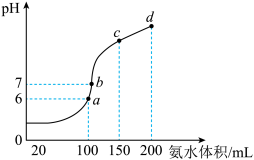
(5)试分析图中a、b、c、d四个点,水的电离程度最大的是_______ ;
(6)在b点,溶液中各离子浓度由大到小的排列顺序是_______ ;
(7)写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH )=
)=_______
(8)25℃时, 同浓度的下列溶液:①HCl;②NH4Cl;③Na2CO3;④NaHCO3,其中pH由大到小的顺序是_______ 。
资料:HClO的电离常数为Ka=4.7×10-8;H2CO3的电离常数为Ka1=4.3×10-7,Ka2=5.6×10-11;HClO的氧化性和杀菌消毒效果强于ClO-。
84消毒液和医用酒精都是重要的消毒剂。某实验小组同学围绕“84消毒液能否与医用酒精混合使用”这一问题进行了如下实验。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 分别取40 mL 84消毒液和医用酒精混合均匀,并测量溶液温度变化 | 溶液温度由20℃升高至23℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化 |
| Ⅱ | 分别取40 mL医用酒精和蒸馏水混合均匀,水浴加热至23℃ | 溶液中无明显现象 |
| Ⅲ | 分别取_______mL 84消毒液和蒸馏水混合均匀,水浴加热至23℃ | 溶液中无明显现象,略有刺激性气味 |
(2)实验Ⅲ中应分别取
(3)由实验现象推断,84消毒液和医用酒精
(4)84消毒液可由氯气与NaOH溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的NaOH,请运用平衡移动原理解释NaOH的作用:( 用离子方程式表示并配以必要的文字说明)
II.室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:

(5)试分析图中a、b、c、d四个点,水的电离程度最大的是
(6)在b点,溶液中各离子浓度由大到小的排列顺序是
(7)写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH
 )=
)=(8)25℃时, 同浓度的下列溶液:①HCl;②NH4Cl;③Na2CO3;④NaHCO3,其中pH由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)当温度降低时, 值
值_______ (填“增大”、“减小”或“不变”);
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性由强到弱的顺序是_______ (用化学式表示)。
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是_______ (填序号)。
A.升高温度 B.加少量冰醋酸 C.加少量的 固体 D.加水稀释
固体 D.加水稀释
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_______ 。
(3)已知草酸是一种二元弱酸,其电离常数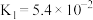 ,
,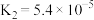 ,写出草酸的电离方程式
,写出草酸的电离方程式_______ 、_______ ,试从电离平衡移动的角度解释 的原因
的原因_______ 。
| 酸 |  |  | HCN | HClO |
电离平衡常数( ) ) |  |  | 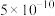 |  |
(1)当温度降低时,
 值
值(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性由强到弱的顺序是
②下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加少量冰醋酸 C.加少量的
 固体 D.加水稀释
固体 D.加水稀释③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知草酸是一种二元弱酸,其电离常数
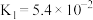 ,
,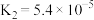 ,写出草酸的电离方程式
,写出草酸的电离方程式 的原因
的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
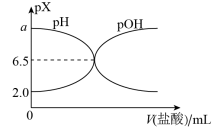
【推荐2】已知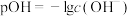 。T℃时,向50mL
。T℃时,向50mL 一元碱MOH溶液中滴加
一元碱MOH溶液中滴加 盐酸,溶液的pH、pOH随滴入盐酸体积的变化如图所示。
盐酸,溶液的pH、pOH随滴入盐酸体积的变化如图所示。
(1)当 时,溶液中
时,溶液中
_______  (填“>”、“<”或“=”,下同)。
(填“>”、“<”或“=”,下同)。
(2)T_______ 25℃,判断依据是_______ ;a=_______ 。
(3)T℃时,电离常数 的值为
的值为_______ (保留两位有效数字)。
(4)盐酸与MOH溶液恰好中和时,所得溶液的pH_______ 6.5。
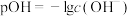 。T℃时,向50mL
。T℃时,向50mL 一元碱MOH溶液中滴加
一元碱MOH溶液中滴加 盐酸,溶液的pH、pOH随滴入盐酸体积的变化如图所示。
盐酸,溶液的pH、pOH随滴入盐酸体积的变化如图所示。
(1)当
 时,溶液中
时,溶液中
 (填“>”、“<”或“=”,下同)。
(填“>”、“<”或“=”,下同)。(2)T
(3)T℃时,电离常数
 的值为
的值为(4)盐酸与MOH溶液恰好中和时,所得溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】填空。
(1)某温度时,测得0.01mol·L-1NaOH溶液的pH=11,该温度下水的离子积Kw=_______ 。该温度下,将pH=12的NaOH溶液VamL与pH=2的H2SO4溶液VbmL混合,混合后溶液的pH=11,则Va:Vb=_______ 。
(2)用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则溶液中c(H+)_______ (填“>”“<”或“=”)c(OH-),c(HCN)+c(CN-)=_______ mol·L-1。
(3)室温下将amol·L-1的HCN与0.1mol·L-1的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示HCN的电离常数Ka=_______ 。
(1)某温度时,测得0.01mol·L-1NaOH溶液的pH=11,该温度下水的离子积Kw=
(2)用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则溶液中c(H+)
(3)室温下将amol·L-1的HCN与0.1mol·L-1的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,有浓度均为0.10 mol/L的下列4种溶液:①NaCN溶液 ②NaOH溶液③CH3COOH溶液 ④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是_______ (填序号),其中②由水电离的H+浓度为_______ 。
(2)①中各离子浓度由大到小的顺序是_______ 。向①溶液中通入少量CO2,则发生反应的离子方程式为_______ 。
(3)用离子方程式解释NaCN溶液显碱性的原因_______ 。
(4)CH3COOH和CH3COONa混合溶液中,若溶液pH=6则溶液中c(CH3COO-)-c(Na+)=_______ mol/L(填精确值)。
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 mol/L | Ka1=4×10-7 mol/L Ka2=5.6×10-11 mol/L | Ka=1.7×10-5 mol/L |
(1)这4种溶液pH由大到小的顺序是
(2)①中各离子浓度由大到小的顺序是
(3)用离子方程式解释NaCN溶液显碱性的原因
(4)CH3COOH和CH3COONa混合溶液中,若溶液pH=6则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知 的
的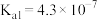 ,
, ;
; 的
的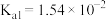 ,
,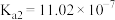 ;
; 的
的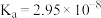 。
。
①室温下,0.1mol/L 溶液的pH
溶液的pH______ 0.1mol/L 溶液的pH。(填“>”、“<”或“=”)
溶液的pH。(填“>”、“<”或“=”)
②浓度均为0.1mol/L的 和
和 混合溶液中
混合溶液中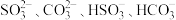 浓度从大到小的顺序为
浓度从大到小的顺序为____________ 。
 的
的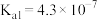 ,
, ;
; 的
的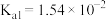 ,
,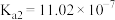 ;
; 的
的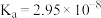 。
。①室温下,0.1mol/L
 溶液的pH
溶液的pH 溶液的pH。(填“>”、“<”或“=”)
溶液的pH。(填“>”、“<”或“=”)②浓度均为0.1mol/L的
 和
和 混合溶液中
混合溶液中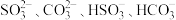 浓度从大到小的顺序为
浓度从大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)常温下,a mL 0.1 mol·L-1的CH3COOH溶液与b mL 0.1 mol·L-1的NaOH溶液混合,充分反应。
①写出反应的离子方程式:______________________ 。
②0.1 mol·L-1的CH3COOH溶液与 0.1 mol·L-1的NaOH溶液,两溶液pH之和__________ 14(填“<”、“=”或“>”)。
③若a=b,则反应后溶液中粒子(除水分子外)浓度从大到小的顺序是_________________ 。
④若混合后溶液呈中性,则a____________ b,反应后溶液中c(CH3COO-)________ c(Na+)(填“<”、“=”或“>”)。
(2)常温下,a mL pH=2的H2SO4溶液与b mL pH=12的氨水溶液混合,充分反应。
①混合前,两溶液中由水电离出的H+浓度之比为________ ;
②若a=b,则反应后溶液显______ (填“酸性”、“ 中性”或“碱性”)。
①写出反应的离子方程式:
②0.1 mol·L-1的CH3COOH溶液与 0.1 mol·L-1的NaOH溶液,两溶液pH之和
③若a=b,则反应后溶液中粒子(除水分子外)浓度从大到小的顺序是
④若混合后溶液呈中性,则a
(2)常温下,a mL pH=2的H2SO4溶液与b mL pH=12的氨水溶液混合,充分反应。
①混合前,两溶液中由水电离出的H+浓度之比为
②若a=b,则反应后溶液显
您最近一年使用:0次

 ,弱酸)及其化合物在工业中有重要作用。草酸具有较强的还原性,与氧化剂作用易被氧化成二氧化碳和水,故实验室可利用草酸测定次氯酸钠溶液的浓度。实验步骤如下:取
,弱酸)及其化合物在工业中有重要作用。草酸具有较强的还原性,与氧化剂作用易被氧化成二氧化碳和水,故实验室可利用草酸测定次氯酸钠溶液的浓度。实验步骤如下:取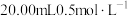 草酸溶液于锥形瓶中,用次氯酸钠溶液滴定,至终点时消耗次氯酸钠溶液为
草酸溶液于锥形瓶中,用次氯酸钠溶液滴定,至终点时消耗次氯酸钠溶液为 。
。 。
。


