常温下。向20.00mL0.1mol/LHA溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法不正确的是
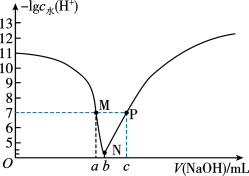

| A.常温下,Ka(HA)约为10-5 |
| B.M、P两点溶液对应的pH=7 |
| C.b=20.00 |
| D.M点后溶液中均存在c(Na+)>c(A-) |
2018·河北石家庄·一模 查看更多[17]
北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题江西省南昌县莲塘第一中学2022-2023学年高二上学期11月期中化学试题(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像北京市第二中学2022-2023学年高二上学期11月月考化学试题(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)山东师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)专题11 水溶液中的离子平衡(水的电离、电离常数、水解常数、电离水解判断、KSP)-2021年高考化学必做热点专题第26讲 水的电离和溶液的pH (精讲)-2021年高考化学一轮复习讲练测河北省冀州中学2020届高三11月月考化学试题(已下线)专题8.2 水的电离和溶液的pH(讲)-《2020年高考一轮复习讲练测》(已下线)第8章 单元测试(测)-《2020年高考一轮复习讲练测》河北省武邑中学2018届高三下学期期中考试化学试题河北省石家庄市2018届高三下学期4月一模考试理综化学试题
更新时间:2018/04/11 09:34:54
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】表1是元素周期表的一部分:
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00 mL浓度均为0.1000mol/ L的两种酸HX、HZ(忽略溶液体积变化),实验数据如表2,下列判断正确的是
| 氧 | X |
| Y | Z |
表1
数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
HX | HZ | ||
① | 0 | 3 | 1 |
② | 20.00 | a | 7 |
表2
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00 mL浓度均为0.1000mol/ L的两种酸HX、HZ(忽略溶液体积变化),实验数据如表2,下列判断正确的是
| A.表格中a<7 |
| B.25℃时,HX的电离常数Ka=1×10-6 |
| C.Y和Z两元素的简单氢化物受热分解,前者分解温度高 |
| D.0.1000mol/L Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000mol/L |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】水的电离平衡曲线如图所示。下列说法错误的是
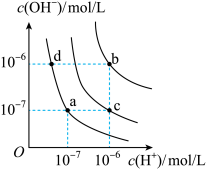

| A.图中对应点的温度关系为b>c>a=d |
| B.纯水仅升高温度,可从a点变到b点 |
| C.水的离子积常数Kw数值大小关系为b>c>d |
| D.在b点对应温度下,0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合,混合后c(H+)=1×10-7 mol·L-1 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知:常温下,将浓度均为0.2mol·L-1的HNO2溶液和NaNO2溶液等体积混合,得到pH=4的混合溶液,下列对该混合溶液的判断正确的是( )
| A.水电离的c(H+)=1×10-10mol·L-1 |
| B.c(NO2-)+c(OH-)=0.1mol·L-1 |
| C.c(NO2-)+c(HNO2)<0.2mol·L-1 |
| D.c(NO2-)>c(HNO2)>c(Na+)>c(H+) |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】25℃时100 mL1 mol/L的三种盐溶液NaX、NaY、NaZ、pH分别为7、8、9下列说法正确的是
| A.HX、HY、HZ的酸性依次增强,电离平衡常数依次减小 |
| B.三种溶液所含阴、阳离子的总数依次增多 |
| C.三种溶液均加水稀释到1000 mL,pH分别变为8、9、10 |
| D.2c(X-)-c(Y- )=c(HY)+c(Z-)+c(HZ) |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】实验室制备亚硫酸钠的过程如下:将饱和碳酸钠溶液加热到40°C,通入二氧化硫至饱和后,再加入碳酸钠固体,在避免与空气接触的情况下结晶而制得。
(已知:H2SO3:Ka1=1.5×10-2;Ka2=6.3×10-8;H2CO3:Ka1=4.4×10-7;Ka2=4.7×10-11)
下列说法正确的是
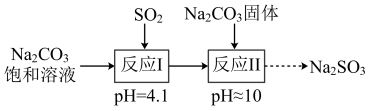
(已知:H2SO3:Ka1=1.5×10-2;Ka2=6.3×10-8;H2CO3:Ka1=4.4×10-7;Ka2=4.7×10-11)
下列说法正确的是

A.饱和Na2CO3溶液中存在c(Na+)+c(H+)=c(H2CO3)+c(HCO )+c(CO )+c(CO ) ) |
B.“反应I”的离子方程式为2CO +SO2+H2O=2HCO +SO2+H2O=2HCO +SO +SO |
C.“反应I”得到的溶液中有c(HSO )>c(SO )>c(SO ) ) |
| D.“反应II”中有大量气体产生 |
您最近半年使用:0次



