25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为________________________ 。
(2)同浓度的CH3COO−、HCO3-、CO32-、ClO−结合H+的能力由强到弱的顺序为________________ 。
(3)常温下0.1 mol⋅L−1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH−)
D.c(OH−)/c(H+) E.[c(CH3COO−).c(H+)]/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是_____________ 。
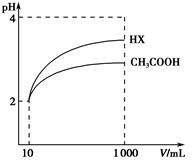
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数________ (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________ ,稀释后,HX溶液中由水电离出来的c(H+)________ (填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是_______________________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10−5 | K1=4.3×10−7 K2=5.6×10−11 | 3.0×10−8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)同浓度的CH3COO−、HCO3-、CO32-、ClO−结合H+的能力由强到弱的顺序为
(3)常温下0.1 mol⋅L−1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH−)
D.c(OH−)/c(H+) E.[c(CH3COO−).c(H+)]/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数

15-16高二上·河北邢台·阶段练习 查看更多[5]
2015-2016学年河北省邢台一中高二上第一次月考化学试卷宁夏石嘴山市第三中学2016-2017学年高二下学期第二次(5月)月考化学试题(已下线)2018年10月7日 《每日一题》一轮复习—每周一测(已下线)2019年10月6日 《每日一题》2020年高考一轮复习 ——每周一测广西南宁市上林县中学2020-2021学年高二上学期期末考试化学试题
更新时间:2018-10-12 11:37:37
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】已知25℃时有关弱酸的电离平衡常数:
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为______________ (填序号)。
(2) 25℃时,将20mL0.1mol/LCH3COOH 溶液和20mL0.1mol/LHSCN 溶液分别与20mL0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V) 随时间(t) 的变化如右图所示,反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是________ 。反应结束后所得两溶液中,c (CH3COO-) ____ c (SCN-) (填“>”、“<”或“=")。

(3)若保持温度不变,在醋酸溶液中加少量盐酸,下列量会变小的是___ (填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
(2) 25℃时,将20mL0.1mol/LCH3COOH 溶液和20mL0.1mol/LHSCN 溶液分别与20mL0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V) 随时间(t) 的变化如右图所示,反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是

(3)若保持温度不变,在醋酸溶液中加少量盐酸,下列量会变小的是
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题
(1)在常温下,将浓度均为 的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=
的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=___________ (已知lg5=0.7)
(2)25℃时,pH均为2的三种酸的电离平衡常数如下表:
试回答下列问题:
①下列四种离子结合质子能力最强的是___________ (填序号)。
a. b.
b. c.
c. d.
d.
②常温下将 溶液加水稀释过程中,下列表达式的数据一定变大的是
溶液加水稀释过程中,下列表达式的数据一定变大的是___________ 。
A. B.
B. C.
C. D.
D. E.
E.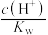
③体积均为10mL,pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
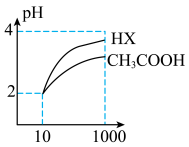
稀释后,HX溶液中水电离出来的
___________ (填“>”、“<”或“=”)醋酸溶液中水电离出来的 ;
; 的电离平衡常数
的电离平衡常数___________ (填“>”、“<”或“=”)HX的电离平衡常数,理由是___________ 。
(1)在常温下,将浓度均为
 的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=
的硫酸与氢氧化钠等体积混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=(2)25℃时,pH均为2的三种酸的电离平衡常数如下表:
| 化学式 |  |  |  |
| 电离平衡常数 |  |  、 、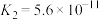 |  |
①下列四种离子结合质子能力最强的是
a.
 b.
b. c.
c. d.
d.
②常温下将
 溶液加水稀释过程中,下列表达式的数据一定变大的是
溶液加水稀释过程中,下列表达式的数据一定变大的是A.
 B.
B. C.
C. D.
D. E.
E.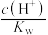
③体积均为10mL,pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

稀释后,HX溶液中水电离出来的

 ;
; 的电离平衡常数
的电离平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知部分酸的电离平衡常数如下:
(1)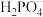 、
、 、
、 、
、 四种离子结合
四种离子结合 能力由强到弱的顺序是
能力由强到弱的顺序是_______ (用离子符号表示)。
(2) 时,向
时,向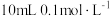 的
的 溶液中加入蒸馏水,将其稀释到
溶液中加入蒸馏水,将其稀释到 后,下列说法正确的是_______。
后,下列说法正确的是_______。
(3)取等体积的 均为a的醋酸和次氯酸两种溶液,分别用等浓度的
均为a的醋酸和次氯酸两种溶液,分别用等浓度的 稀溶液恰好完全中和时,消耗
稀溶液恰好完全中和时,消耗 溶液的体积分别为
溶液的体积分别为 ,
, ,则大小关系为:
,则大小关系为:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4) 溶液与足量的
溶液与足量的 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
| 弱酸 |  |  |  |  |  |
电离常数( ) ) |  | 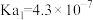 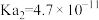 | 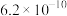 |  | 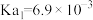 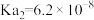 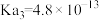 |
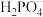 、
、 、
、 、
、 四种离子结合
四种离子结合 能力由强到弱的顺序是
能力由强到弱的顺序是(2)
 时,向
时,向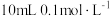 的
的 溶液中加入蒸馏水,将其稀释到
溶液中加入蒸馏水,将其稀释到 后,下列说法正确的是_______。
后,下列说法正确的是_______。A. 的电离程度增大 的电离程度增大 | B.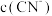 减小 减小 |
C. 增大 增大 | D. 的数目增多 的数目增多 |
 均为a的醋酸和次氯酸两种溶液,分别用等浓度的
均为a的醋酸和次氯酸两种溶液,分别用等浓度的 稀溶液恰好完全中和时,消耗
稀溶液恰好完全中和时,消耗 溶液的体积分别为
溶液的体积分别为 ,
, ,则大小关系为:
,则大小关系为:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)
 溶液与足量的
溶液与足量的 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
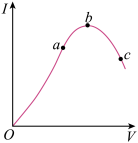
(1)“O”点导电能力为0的理由是_________________________ 。
(2)写出醋酸的电离方程式___________________________________________ 。
(3)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(4)a、b、c三点处,电离程度最大的是________ 。
(5)醋酸与氨水反应的离子方程式:__________________ 。

(1)“O”点导电能力为0的理由是
(2)写出醋酸的电离方程式
(3)a、b、c三点溶液中氢离子浓度由小到大的顺序为
(4)a、b、c三点处,电离程度最大的是
(5)醋酸与氨水反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】25℃时,50mL0.10mol·L-1醋酸中存在下述平衡:CH3COOH⇌CH3COO-+H+,请回答以下问题:
(1)加入少量冰醋酸,平衡将___________ (填“向左”“向右”或“不”) 移动,溶液中c(H+)将___________ (填“增大”“减小”或“不变”);
(2)加入一定量蒸馏水,平衡将___________ (填“向左”“向右”或“不”) 移动,溶液中c(H+)将___________ (填“增大”“减小”或“不变”),c(OH-)将___________ (填“增大”“减小”或“不变”);
(3)加入20mL0.10mol·L-1NaCl溶液,平衡将___________ (填“向左”“向右”或“不”) 移动,溶液中c(H+)将___________ (填“增大”“减小”或“不变”)。
(1)加入少量冰醋酸,平衡将
(2)加入一定量蒸馏水,平衡将
(3)加入20mL0.10mol·L-1NaCl溶液,平衡将
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】请回答下列问题:
(1)某浓度的稀氨水中存在电离平衡: ,若想增大该溶液中
,若想增大该溶液中 的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)
的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)( )
A.适当升高温度 B.加入NH4Cl固体 C.通入NH3 D.加入少量浓盐酸
(2)常温下,有pH相同、体积相同的a.CH3COOH溶液和b.HCl溶液,现采取以下措施:
①分别加适量醋酸钠晶体后,CH3COOH溶液中c(H+)________ (填“增大”“减小”或“不变”,下同),HCl溶液中c(H+)___________ 。
②分别加水稀释10倍后,CH3COOH溶液中的c(H+)_______ (填“>”“=”或“<”)HCl溶液中的c(H+)。
③分别加等浓度的NaOH溶液至恰好反应,所需NaOH溶液的体积:CH3COOH溶液______ (填“>”“=”或“<”)HCl溶液。
④温度都升高20℃,CH3COOH溶液中c(H+)_______ (填“>”“=”或“<”)HCl溶液中c(H+)。
(3)将0.1 mol/L的CH3COOH溶液加水稀释,下列有关稀释后CH3COOH溶液的说法正确的是( )
A.电离程度增大 B.溶液中离子总数增多
C.溶液导电性增强 D.溶液中醋酸分子增多
(1)某浓度的稀氨水中存在电离平衡:
 ,若想增大该溶液中
,若想增大该溶液中 的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)
的浓度而不增大OH-的浓度,应采取的措施是(忽略溶液体积的变化)A.适当升高温度 B.加入NH4Cl固体 C.通入NH3 D.加入少量浓盐酸
(2)常温下,有pH相同、体积相同的a.CH3COOH溶液和b.HCl溶液,现采取以下措施:
①分别加适量醋酸钠晶体后,CH3COOH溶液中c(H+)
②分别加水稀释10倍后,CH3COOH溶液中的c(H+)
③分别加等浓度的NaOH溶液至恰好反应,所需NaOH溶液的体积:CH3COOH溶液
④温度都升高20℃,CH3COOH溶液中c(H+)
(3)将0.1 mol/L的CH3COOH溶液加水稀释,下列有关稀释后CH3COOH溶液的说法正确的是
A.电离程度增大 B.溶液中离子总数增多
C.溶液导电性增强 D.溶液中醋酸分子增多
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】Ⅰ.食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
请回答下列问题:
(1)25℃时,0.10mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)_______ ;
(2)常温下,将20mL0.10mol·L-1CH3COOH溶液和 20mL0.10mol·L-1HNO2溶液分别与 20mL 0.10mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v (CH3COOH )_______ v (HNO2)(填“>”、“<”或“=”)。
②充分反应后。两溶液中c(CH3COO-)_______ c(NO2-)(填“>”、“<”或“=”)。
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的PH=6,则混合
液中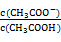 =
=_________ ;
(4)常温下,下列方法可以使0.1mol • L-1CH3COOH的电离程度增大的是_____________ 。
Ⅱ.常温时向一定体积pH= 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的ph=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积之比是____________________ 。
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)
(2)常温下,将20mL0.10mol·L-1CH3COOH溶液和 20mL0.10mol·L-1HNO2溶液分别与 20mL 0.10mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v (CH3COOH )
②充分反应后。两溶液中c(CH3COO-)
(3)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的PH=6,则混合
液中
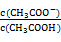 =
=(4)常温下,下列方法可以使0.1mol • L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
Ⅱ.常温时向一定体积pH= 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的ph=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积之比是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】25℃时,电离平衡常数:
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________ 。
a.加入少量0.10mol·L﹣1的稀盐酸
b.加热 c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸 e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________ 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
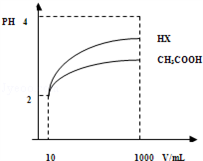
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数_____ (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_____________________ ,稀释后,HX溶液中水电离出来的c(H+)____ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_________________________ 。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________ (填准确数值)。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH
 CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是a.加入少量0.10mol·L﹣1的稀盐酸
b.加热 c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸 e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】水溶液中的离子反应与平衡是化学反应原理的重要组成部分,回答下列问题:
(1)常温下,pH均为5的NH4Cl溶液与稀硫酸中,水电离出的 浓度之比约为
浓度之比约为___________ 。
(2)将FeCl3溶液加热,溶液pH___________ (填“增大”“不变”或“减小”)。
(3)已知:25℃时,H3PO3的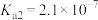 ,H3PO3溶液与过量的NaOH溶液反应生成Na2HPO3,则H3PO3为
,H3PO3溶液与过量的NaOH溶液反应生成Na2HPO3,则H3PO3为___________ 元酸; 的NaH2PO3溶液显
的NaH2PO3溶液显___________ (填“酸”“中”或“碱”)性,在该溶液中存在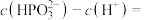
___________ 。
(4)某学习小组用“间接碘量法”测定含有 晶体的试样(不含能与
晶体的试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用
发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知:
Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知: ,
, 。
。
①可选用___________ 作滴定指示剂,滴定终点的现象是___________ 。
②该试样中 的质量分数为
的质量分数为___________ 。
(1)常温下,pH均为5的NH4Cl溶液与稀硫酸中,水电离出的
 浓度之比约为
浓度之比约为(2)将FeCl3溶液加热,溶液pH
(3)已知:25℃时,H3PO3的
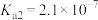 ,H3PO3溶液与过量的NaOH溶液反应生成Na2HPO3,则H3PO3为
,H3PO3溶液与过量的NaOH溶液反应生成Na2HPO3,则H3PO3为 的NaH2PO3溶液显
的NaH2PO3溶液显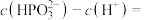
(4)某学习小组用“间接碘量法”测定含有
 晶体的试样(不含能与
晶体的试样(不含能与 发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用
发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知:
Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知: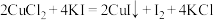 ,
, 。
。①可选用
②该试样中
 的质量分数为
的质量分数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知常温下,几种电解质的电离常数如表所示:
回答下列问题:
(1)在 溶液中滴几滴酚酞,可能的现象是
溶液中滴几滴酚酞,可能的现象是_______ 。
(2)常温下,在醋酸溶液中加蒸馏水, 将
将_______ (填“增大”“减小”或“不变”)。
(3)常温下,体积均为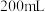 、物质的量浓度相等的下列三种溶液:
、物质的量浓度相等的下列三种溶液:
① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液
溶液
其中离子总数由大到小的排序为_______ (填序号)。
(4)向 溶液通入少量
溶液通入少量 ,离子方程式为
,离子方程式为_______ 。
(5) 溶液中
溶液中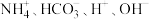 离子浓度大小排序为
离子浓度大小排序为_______ 。
(6)常温下,向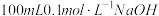 溶液中缓缓通入
溶液中缓缓通入 使
使 时,溶液
时,溶液
_______ 。
| 电解质 |  |  |  |  |
 或 或 |  |  | 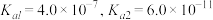 |  |
(1)在
 溶液中滴几滴酚酞,可能的现象是
溶液中滴几滴酚酞,可能的现象是(2)常温下,在醋酸溶液中加蒸馏水,
 将
将(3)常温下,体积均为
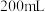 、物质的量浓度相等的下列三种溶液:
、物质的量浓度相等的下列三种溶液:①
 溶液;②
溶液;② 溶液;③
溶液;③ 溶液
溶液其中离子总数由大到小的排序为
(4)向
 溶液通入少量
溶液通入少量 ,离子方程式为
,离子方程式为(5)
 溶液中
溶液中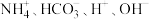 离子浓度大小排序为
离子浓度大小排序为(6)常温下,向
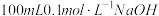 溶液中缓缓通入
溶液中缓缓通入 使
使 时,溶液
时,溶液
您最近一年使用:0次





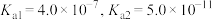
 的溶液①中由水电离出的
的溶液①中由水电离出的 为
为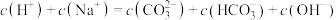
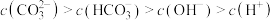

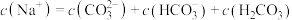
 ,该溶液的
,该溶液的
 的①溶液与
的①溶液与 的③溶液混合,若所得混合溶液的
的③溶液混合,若所得混合溶液的 ,则①和②溶液的体积比为
,则①和②溶液的体积比为

