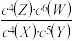对于平衡体系mA(g)+nB(g)⇌pC(g)+qD(g) △H=b kJ·mol-1,下列结论中错误的是
| A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C.保持其它条件不变,升高温度,D的体积分数增大说明该反应的△H<0。 |
| D.若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol |
17-18高一下·辽宁抚顺·期末 查看更多[7]
更新时间:2018-07-25 21:32:58
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】化学中常用图像直观地描述化学反应的进程或结果。下列有些图像描述正确的是


A.当反应COCl2(g) CO(g)+Cl2(g);△H>0,达到平衡时①升温②减压③加催化剂都能提高COCl2转化率 CO(g)+Cl2(g);△H>0,达到平衡时①升温②减压③加催化剂都能提高COCl2转化率 |
B.图1可能表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图2可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.据图3,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】在3个初始温度均为T ℃的密闭容器中发生反应:2SO2(g) + O2(g)⇌2SO3(g) ΔH < 0。下列说法错误的是
| 容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
| SO2 | O2 | SO3 | ||||
I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
III | 恒温恒压 | 2.0 L | 0 | 0 | 4 | b |
| A.达平衡时,SO2的转化率α(I) = 80% |
| B.b > 3.2 |
| C.平衡时v正(SO2):v(I) < v(II) |
| D.若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0 mol SO3(g),则反应将向正反应方向进行 |
您最近一年使用:0次
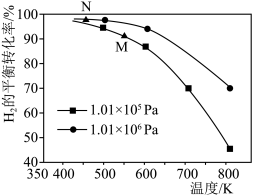
【推荐1】已知反应:CO(g)+3H2(g)  CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为
CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为 )。下列有关说法正确的是
)。下列有关说法正确的是
 CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为
CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为 )。下列有关说法正确的是
)。下列有关说法正确的是 
| A.上述反应逆反应的ΔH > 0 |
| B.N点时的反应速率一定比M点的快 |
| C.降低温度,H2的转化率可达到100% |
| D.工业上用此法制取甲烷应采用更高的压强 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】高温下,某反应达到平衡,平衡常数K=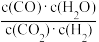 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
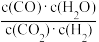 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )| A.该反应的焓变为正值 |
| B.恒温下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应为放热反应 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】温度为T°C,向体积不等的密闭容器中分别加入足量活性炭和lmolNO2,发生反应:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示(V1<V2<V3)。下列说法正确的是
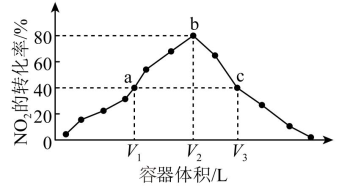

| A.图中a点所示条件下v(正)=v(逆) |
| B.T°C时,a、b两点时反应的平衡常数Ka<Kb |
| C.向b点体系中充入一定量NO2,达到新平衡时,NO2转化率将增大 |
| D.对c点容器加压,缩小容器体积,则此时v(逆)>v(正) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】对于平衡体系mA(g)+nB(g)=pC(g)+qD(g) ΔH<0。下列结论中错误的是
| A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n |
| C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D.若改变条件使平衡体系中物质的浓度发生变化,则平衡一定发生移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】 和
和 存在平衡:
存在平衡: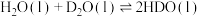
 ,已知在298K时,平衡常数
,已知在298K时,平衡常数 。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离
。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离 和
和 。获得相同的吸附量(如
。获得相同的吸附量(如 )时,
)时, 需要的时间至少是
需要的时间至少是 的2.5倍。下列叙述正确的是
的2.5倍。下列叙述正确的是
 和
和 存在平衡:
存在平衡: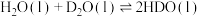
 ,已知在298K时,平衡常数
,已知在298K时,平衡常数 。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离
。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离 和
和 。获得相同的吸附量(如
。获得相同的吸附量(如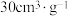 )时,
)时, 需要的时间至少是
需要的时间至少是 的2.5倍。下列叙述正确的是
的2.5倍。下列叙述正确的是A.308K时,上述反应的平衡常数 |
B.达到平衡后增大 的量,则 的量,则 的平衡转化率增大 的平衡转化率增大 |
| C.上述混合物通过W材料,HDO平衡浓度降低 |
D.298K时,若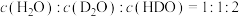 ,则反应向正反应方向进行 ,则反应向正反应方向进行 |
您最近一年使用:0次