下列有关电解质溶液的说法正确的是( )
| A.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]一定增大 |
| B.向0.1 mol·L-1的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 |
| C.向0.1 mol·L-1的NaHSO3溶液中加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-) |
| D.可用浓度大于0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃[已知Ksp(BaSO4)=1.1×10-10] |
更新时间:2019-05-21 19:12:01
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
| A.铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| B.同温下,等体积pH相同的NH4Cl溶液和HCl溶液中由水电离出的H+数目相同 |
| C.常温常压下,78 g苯中含有双键的数目为3×6.02×1023 |
| D.室温下,向0.1mol/L CH3COOH溶液中加入少量冰醋酸,溶液的导电能力增强 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】对于常温下0.1 mol·L-1氨水和0.1 mol·L-1醋酸,下列说法正确的是
| A.0.1 mol·L-1氨水,溶液的pH=13 |
B.向0.1 mol·L-1氨水中加入少量水,溶液中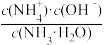 增大 增大 |
| C.0.1 mol·L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D.向0.1 mol·L-1醋酸中加入少量水,醋酸电离平衡正向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】下列关于常温下的电解质溶液的说法正确的是
A.35℃时,纯水中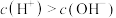 |
B.向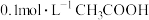 溶液加水稀释时会引起溶液中 溶液加水稀释时会引起溶液中 减小 减小 |
| C.电离平衡右移,弱电解质的电离程度一定增大 |
| D.除了水的电离平衡外,盐酸中不存在其他电离平衡 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.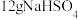 晶体中阳离子数为 晶体中阳离子数为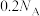 |
B. 氯化铵水溶液中阴阳离子数之和大于 氯化铵水溶液中阴阳离子数之和大于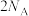 |
C.常温下,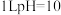 的纯碱溶液中,由水电离产生的 的纯碱溶液中,由水电离产生的 数为 数为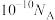 |
D.电解精炼铜时,若阳极质量减少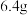 ,转移电子数一定为 ,转移电子数一定为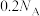 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,用0.100 mol·L-1的盐酸滴定20 mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示。下列说法中错误的是


| A.BOH的电离常数Kb约为1×10-5 |
| B.B+与Cl-的导电能力:b>a |
| C.a点溶液中:c(B+)+2c(H+)=2c(OH-)+c(BOH) |
| D.滴定至pH=7时,c(B+)=c(Cl-)=0.1 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某元素M的氢氧化物 在水中的溶解反应为:
在水中的溶解反应为:
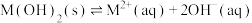

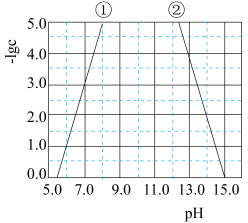
25℃,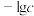 与pH的关系如图所示,c为
与pH的关系如图所示,c为 或
或 物质的量浓度的值。下列说法正确的是
物质的量浓度的值。下列说法正确的是
 在水中的溶解反应为:
在水中的溶解反应为: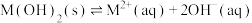


25℃,
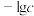 与pH的关系如图所示,c为
与pH的关系如图所示,c为 或
或 物质的量浓度的值。下列说法正确的是
物质的量浓度的值。下列说法正确的是A.曲线①代表 与pH的关系 与pH的关系 |
B. 的 的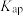 约为 约为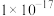 |
C.当溶液的pH达到15.0以上时, 才开始溶解 才开始溶解 |
D.向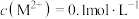 的溶液中加入NaOH溶液至 的溶液中加入NaOH溶液至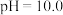 ,体系中元素M主要以 ,体系中元素M主要以 存在 存在 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
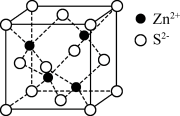
【推荐2】自然界中原生铜的硫化物经氧化、淋滤后变成 溶液,遇到ZnS(晶胞结构如图所示,晶胞参数为a nm)可缓慢转化为CuS。已知:
溶液,遇到ZnS(晶胞结构如图所示,晶胞参数为a nm)可缓慢转化为CuS。已知: ,
,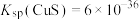 。下列说法正确的是
。下列说法正确的是
 溶液,遇到ZnS(晶胞结构如图所示,晶胞参数为a nm)可缓慢转化为CuS。已知:
溶液,遇到ZnS(晶胞结构如图所示,晶胞参数为a nm)可缓慢转化为CuS。已知: ,
,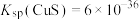 。下列说法正确的是
。下列说法正确的是
A. 的配位数为6 的配位数为6 |
B. 与 与 的最短距离为 的最短距离为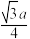 nm nm |
C.体系达平衡后,溶液中: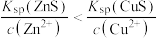 |
D.要使反应 正向进行,需满足 正向进行,需满足 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】相关物质的溶度积常数见下表(25℃):
下列有关说法不正确的是
| 物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
 | 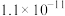 | 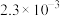 |  | 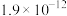 |
| A.浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| B.在其他条件不变的情况下,向饱和AgCl溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| C.0.11mol/L的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9 |
| D.将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4混合溶液中,先产生Ag2CrO4沉淀 |
您最近一年使用:0次

 为二元酸,其电离过程:
为二元酸,其电离过程: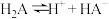 ,
, 。常温时,向15
。常温时,向15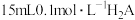 水溶液中逐滴滴加
水溶液中逐滴滴加 溶液,混合溶液中
溶液,混合溶液中 和
和 的物质的量分数
的物质的量分数 随pH变化的关系如图所示。下列叙述错误的是
随pH变化的关系如图所示。下列叙述错误的是
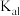 的数量级为
的数量级为
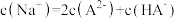 时,加入
时,加入 >15mL
>15mL 的溶液中持续滴加NaOH溶液,水的电离程度先变大后变小
的溶液中持续滴加NaOH溶液,水的电离程度先变大后变小

