研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)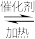 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______ 。
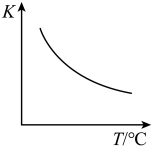
(2)该反应的化学平衡常数表达式K=______ ;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______ v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______ (填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
(3)请写出上述pH变化的原因______ 。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______ (填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______ 。
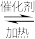 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=
(2)该反应的化学平衡常数表达式K=
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。
更新时间:2019/08/19 07:45:11
|
相似题推荐
【推荐1】二氧化氮可由NO和O2生成,已知在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
(1)已知:K800℃>K1000℃,则该反应的ΔH___ 0(填“大于”或“小于”),用O2表示0~2 s内该反应的平均速率为___ 。
(2)能说明该反应已达到平衡状态的是___ 。
a.容器内气体颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有_____ 。
(4)在题述条件下,计算通入2molNO和1molO2的平衡常数K=___ 。
(5)在题述条件下,若开始通入的是0.2molNO2气体,达到化学平衡时,NO2的转化率为__ 。
(6)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①CH4(g)+4NO(g)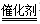 2N2(g)+CO2(g)+2H2O ΔH<0
2N2(g)+CO2(g)+2H2O ΔH<0
②CH4(g)+2NO2(g)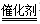 N2(g)+CO2(g)+2H2O(g) ΔH<0
N2(g)+CO2(g)+2H2O(g) ΔH<0
对于反应②,欲提高NO2的转化率,可采取的措施有____ 。
a.增加原催化剂的表面积 b.降低温度 c.减小投料比[n(NO2)/n(CH4)] d.增大压强
 2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH
(2)能说明该反应已达到平衡状态的是
a.容器内气体颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有
(4)在题述条件下,计算通入2molNO和1molO2的平衡常数K=
(5)在题述条件下,若开始通入的是0.2molNO2气体,达到化学平衡时,NO2的转化率为
(6)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①CH4(g)+4NO(g)
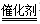 2N2(g)+CO2(g)+2H2O ΔH<0
2N2(g)+CO2(g)+2H2O ΔH<0②CH4(g)+2NO2(g)
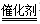 N2(g)+CO2(g)+2H2O(g) ΔH<0
N2(g)+CO2(g)+2H2O(g) ΔH<0对于反应②,欲提高NO2的转化率,可采取的措施有
a.增加原催化剂的表面积 b.降低温度 c.减小投料比[n(NO2)/n(CH4)] d.增大压强
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,v(CO2)=___ mol/(L·min)(计算结果保留2位有效数字)。
(2)能说明上述反应达到平衡状态的是___ (填编号)。
A. 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成1 mol H2,同时生成1 mol CH3OH
D. 混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡混合气体中CO2(g)和H2(g)的质量之比是___ 。
(4)第3分钟时v正(CH3OH)第9 min时v逆(CH3OH)___ (填“>”、“<”“=”或“无法比较”)。

(1)从3 min到9 min,v(CO2)=
(2)能说明上述反应达到平衡状态的是
A. 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成1 mol H2,同时生成1 mol CH3OH
D. 混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡混合气体中CO2(g)和H2(g)的质量之比是
(4)第3分钟时v正(CH3OH)第9 min时v逆(CH3OH)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1) 对于Fe+2H+===Fe2++H2↑改变下列条件对反应速率和产量有何影响 (填“增大”“减小”或“不变”):把铁片改成铁粉:________ ;滴加几滴浓硫酸_______ ;加压:________ ;
(2) 某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
①表中V1=__________ mL
②探究温度对化学反应速率影响的实验编号是________ (填编号)
③实验③测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________ mol·L-1·min-1。
(2) 某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
| 实验 编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
| ① | 10 | V1 | 35 | 25 | |
| ② | 10 | 10 | 30 | 25 | |
| ③ | 10 | 10 | V2 | 50 |
①表中V1=
②探究温度对化学反应速率影响的实验编号是
③实验③测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)===2Fe(s)+3CO(g);
ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)===2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为___________________________________________________________ 。
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
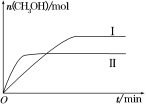
①该反应的平衡常数的表达式为K=________ 。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________ KⅡ(填“大于”、“等于”或“小于”)。
③在图a、b、c三点中,H2的转化率由高到低的顺序是________ (填字母)。
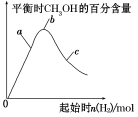
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________ (填序号)。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)===2Fe(s)+3CO(g);
ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)===2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
①该反应的平衡常数的表达式为K=
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ
③在图a、b、c三点中,H2的转化率由高到低的顺序是

(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0;
(1)写出该反应的化学平衡常数表达式K=__________
(2)降低温度,该反应K值__________ ,二氧化硫转化率___________ ,化学反应速率___________ (以上均填增大、减小或不变)。
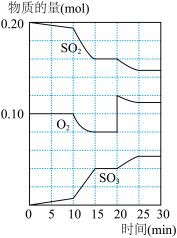
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态时间是___________________________ 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是_______________________ (用文字表达)。
(5)10min到15min的曲线变化的原因可能是____________ (填写编号)。
A、加了催化剂 B、缩小容器体积
C、降低温度 D、增加SO3的物质的量。
(6)若该反应的密闭容器为2L,则反应15min时,v(SO2)=___________
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
A、及时分离出SO3气体 B、适当升高温度
C、增大O2的浓度 D、选择高效的催化剂
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值

(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态时间是
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(5)10min到15min的曲线变化的原因可能是
A、加了催化剂 B、缩小容器体积
C、降低温度 D、增加SO3的物质的量。
(6)若该反应的密闭容器为2L,则反应15min时,v(SO2)=
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是
A、及时分离出SO3气体 B、适当升高温度
C、增大O2的浓度 D、选择高效的催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=__________ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_________ kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_______________ ;③的化学平衡常数K的表达式为_____________ ;
①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=
(2)反应①的化学平衡常数K的表达式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如下图所示。
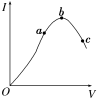
请回答:
(1)“O”点导电能力为0的理由是___________ ;
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为___________ ;
(3)a、b、c三点处,电离程度最大的是___________ ;
(4)若将c点溶液中c(CH3COO-)增大,溶液c(H+)减小,可采取的措施是___________ 。
①加入水 ②加入NaOH固体 ③加入浓硫酸 ④加入Na2CO3固体⑤加入Zn、Mg等金属。

请回答:
(1)“O”点导电能力为0的理由是
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为
(3)a、b、c三点处,电离程度最大的是
(4)若将c点溶液中c(CH3COO-)增大,溶液c(H+)减小,可采取的措施是
①加入水 ②加入NaOH固体 ③加入浓硫酸 ④加入Na2CO3固体⑤加入Zn、Mg等金属。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】根据所学知识,完成下列问题。
(1)下列反应中,属于吸热反应的是___________ (填序号)。
a.灼热的炭与CO2反应 b.煅烧石灰石 c.铝与盐酸反应 d.盐酸与氢氧化钠反应
(2)已知CH4、CH3OH(l)的燃烧热分别为890.3kJ/mol,726.5kJ/mol,
①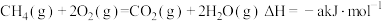 ,则a
,则a___________ 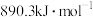 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②写出表示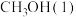 燃烧热的热化学方程式
燃烧热的热化学方程式___________ ;
(3)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,盐碱地呈碱性的原因:___________ (用离子方程式说明);
(4)水溶液是中学化学的重点研究对象、水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中水电离产生的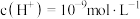 ,则该电解质可能是
,则该电解质可能是___________ (填序号)。
A. B.HCl C.
B.HCl C. D.
D. E.
E.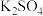
(5)联氨(N2H4)是一种应用广泛的化工原料,可用作火箭燃料。N2H4性质与NH3类似,在水中,N2H4是一种二元弱碱,请写出等物质的量N2H4与硫酸反应生成的盐的化学式为___________ 。
(1)下列反应中,属于吸热反应的是
a.灼热的炭与CO2反应 b.煅烧石灰石 c.铝与盐酸反应 d.盐酸与氢氧化钠反应
(2)已知CH4、CH3OH(l)的燃烧热分别为890.3kJ/mol,726.5kJ/mol,
①
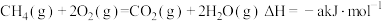 ,则a
,则a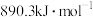 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②写出表示
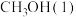 燃烧热的热化学方程式
燃烧热的热化学方程式(3)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,盐碱地呈碱性的原因:
(4)水溶液是中学化学的重点研究对象、水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中水电离产生的
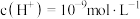 ,则该电解质可能是
,则该电解质可能是A.
 B.HCl C.
B.HCl C. D.
D. E.
E.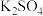
(5)联氨(N2H4)是一种应用广泛的化工原料,可用作火箭燃料。N2H4性质与NH3类似,在水中,N2H4是一种二元弱碱,请写出等物质的量N2H4与硫酸反应生成的盐的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度____ 25℃(选填“大于”、“小于”或“等于”),若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比:
①若所得混合液为中性,则a:b=____ ;此溶液中各种离子的浓度由大到小排列顺序是____ 。
②若所得混合液的pH=2,则a:b=____ 。
(2)25℃时,向水中加入一定量的碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为____ ,由水电离出的c(OH-)=____ mol·L-1。
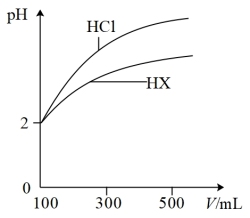
(3)体积均为100mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX是____ (填“强酸”或“弱酸”)。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,等物质的量浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为____ (填化学式)。
②25℃时,在0.5mol/L的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的____ 倍。
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度
①若所得混合液为中性,则a:b=
②若所得混合液的pH=2,则a:b=
(2)25℃时,向水中加入一定量的碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX是

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②25℃时,在0.5mol/L的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向___________ (填“正”或“逆”)反应方向移动;水的电离程度将___________ (填“增大”“减小”或“不变”)。
(2)99℃时,Kw=1.0×10-12,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为___________ 。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气___________ 。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为___________ 。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是___________ (填字母)。
a、 、
、 b、
b、 、
、 c、
c、 、
、 d、H2SO3、
d、H2SO3、
②常温下,NaHSO3溶液显___________ 性(填“酸”“碱”或“中”),溶液中离子浓度从大到小的排列顺序是___________ 。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向
(2)99℃时,Kw=1.0×10-12,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是
a、
 、
、 b、
b、 、
、 c、
c、 、
、 d、H2SO3、
d、H2SO3、
②常温下,NaHSO3溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】冰醋酸的结构简式为:______ ,其属于______ 电解质(填非、强或弱),溶于水的电离方程式为:_________ ,在此溶液中滴加紫色石蕊溶液,溶液变红,加热溶液红色_____ (填加深、变浅或不变),说明冰醋酸溶于水的电离是________ 过程(填吸热或放热)。在100mL0.1mol/L的CH3COOH溶液中,加入100mL0.1mol/L NaOH溶液,恰好反应后溶液呈______ 性(填碱性或酸性),反应后溶液中离子浓度大小为:_______ 溶液中c(CH3COOH)+c(CH3COO-)=______ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。
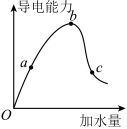
(1)“O”点为什么不导电___________________ 。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________ 。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________ 。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________ 。
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒G.加MgO固体H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________ 。
A.c(H+) B.H+个数C.CH3COOH分子数D.c(H+)/c(CH3COOH)

(1)“O”点为什么不导电
(2)a、b、c三点的氢离子浓度由小到大的顺序为
(3)a、b、c三点中,醋酸的电离程度最大的一点是
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒G.加MgO固体H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是
A.c(H+) B.H+个数C.CH3COOH分子数D.c(H+)/c(CH3COOH)
您最近一年使用:0次



