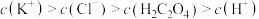常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
| A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-] |
| B.①②等体积混合后,醋酸根离子浓度小于③的二分之一 |
| C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+) |
| D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小 |
2019·上海·模拟预测 查看更多[24]
上海市进才中学2023-2024学年高二下学期3月测试化学试题上海市控江中学2023-2024学年高二上学期等级班阶段测验卷二 化学试题广东广雅中学2022-2023学年高二下学期期中考试化学试题上海市控江中学2022-2023学年高三下学期3月测试化学试题上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题吉林省通化市辉南县第六中学2022-2023学年高二上学期第一次月考化学试题湖南省邵阳市新邵县2021-2022学年高二上学期期末考试化学试题(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)广东省珠海市第二中学2020-2021学年高二上学期10月月考化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)吉林省四平市实验中学2020-2021学年高二12月月考化学试题(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)河北阜城中学2020-2021学年高二上学期期中考试化学试题2019年上海市普通高中学业水平等级性考试(高考)化学试卷河南省平顶山市第一中学2019-2020学年高二下学期开学考试化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题专题2.3 水溶液中的离子平衡(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升吉林省大安一中2019-2020学年高三上学期第四次月考化学试题江西省抚州市南城县第二中学2019-2020学年高二上学期第二次月考化学试题2020届高考化学小题狂练(全国通用版)专练16 盐类的水解
更新时间:2019-10-28 13:08:34
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列实验事实不能 用平衡移动原理解释的是
A. | ||||||
B.
| ||||||
C. | ||||||
D.
|
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】0.1mol·L-1 的氨水中存在如下平衡:NH3·H2O NH4++ OH−,下列叙述正确的是
NH4++ OH−,下列叙述正确的是
 NH4++ OH−,下列叙述正确的是
NH4++ OH−,下列叙述正确的是| A.加入少量 NaOH 固体,c(OH−)减小 |
| B.加水稀释,平衡正向移动,电离平衡常数增大 |
| C.通入少量 HCl 气体,平衡正向移动 |
| D.加入少量 NH4Cl 固体,平衡正向移动 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐3】 是一种三元弱酸。关于常温下
是一种三元弱酸。关于常温下 的
的 溶液,下列说法正确的是
溶液,下列说法正确的是
 是一种三元弱酸。关于常温下
是一种三元弱酸。关于常温下 的
的 溶液,下列说法正确的是
溶液,下列说法正确的是A.该溶液中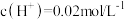 |
B.加水稀释过程中,溶液中 保持不变 保持不变 |
C.随温度升高,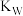 增大,该溶液中 增大,该溶液中 增大、 增大、 减小, 减小, 增大 增大 |
D.加入 溶液至中性时,溶液中 溶液至中性时,溶液中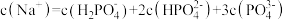 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】氯气可以用于制取漂白剂和自来水杀菌消毒。常温下,溶液中Cl2(aq)、HClO和ClO-物质的量分数(α)随pH变化的关系如图所示。
已知,Cl2(g) Cl2(aq)K1=10-1.2
Cl2(aq)K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl-K2=10-3.4
HClO+H++Cl-K2=10-3.4
下列说法正确的是

已知,Cl2(g)
 Cl2(aq)K1=10-1.2
Cl2(aq)K1=10-1.2Cl2(aq)+H2O
 HClO+H++Cl-K2=10-3.4
HClO+H++Cl-K2=10-3.4下列说法正确的是

A.Cl2(g)+H2O 2H++ClO-+Cl-K3=10-10.9 2H++ClO-+Cl-K3=10-10.9 |
| B.氯气通入水中,c(HClO)+c(ClO-)<c(H+)-c(OH-) |
| C.pH=7.0时漂白能力要比pH=6.0时要强 |
| D.氯气处理自来水时,在夏天的杀菌消毒效果要比在冬天好 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,下列叙述正确的是
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHS溶液:c(Na+)>c(HS-)>c(S2-)>c(H2S) |
C.CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
D.等物质的量的NaClO、Na2CO3混合溶液中:c(HClO)+c(ClO-)=c(HCO )+c(H2CO3)+c(CO )+c(H2CO3)+c(CO ) ) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】室温下将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是
A.c(Cl-)>c(NH )>c(OH-)>c(H+) )>c(OH-)>c(H+) | B.c(NH )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |
C.c(Cl-)=c(NH )>c(H+)=c(OH-) )>c(H+)=c(OH-) | D.c(NH )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】 时,浓度均为
时,浓度均为 的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
 时,浓度均为
时,浓度均为 的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
A.BOH溶于水,其电离方程式是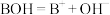 |
B.在 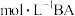 溶液中, 溶液中, |
C.若一定量的上述两溶液混合后 ,则 ,则 |
D.若将 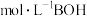 溶液稀释至 溶液稀释至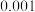  ,则溶液的 ,则溶液的 |
您最近半年使用:0次


 )=c(
)=c( )>c(OH-)
)>c(OH-) 溶液的性质(
溶液的性质( 为
为 为
为 电离平衡常数)。
电离平衡常数)。 溶液的pH,测得约为5.5
溶液的pH,测得约为5.5 ,产生沉淀
,产生沉淀 ,测得溶液pH=7
,测得溶液pH=7