请根据要求填写下列空白:
(1)NaHCO3溶液呈碱性的原因是______________ (用方程式和必要文字表示),写出该溶液存在的物料守恒的关系式 ________________ 。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要产物是________________________ 。
(3)若想除去CuCl2 溶液中混有FeCl3杂质,则往往加入试剂______________ 。
①NaOH ②NH3·H2O ③CuO ④CuCO3
(4)在酸碱滴定中,我们用0.1000mol/L HCl来滴定未知浓度的NaOH溶液,①在滴定过程中,操作或说法错误的是_______________ 。
a.滴定终点为:当滴完最后一滴恰好变色,且在半分钟内不恢复原色
b.进行中和滴定操作时,左手振荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
c.酸式滴定管中的盐酸装液前未经润洗,导致所测定的c(NaOH)偏低。
d.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致所测定的c(NaOH)偏高
②某学生根据三次实验分别记录有关数据如下:
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=________________
(1)NaHCO3溶液呈碱性的原因是
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要产物是
(3)若想除去CuCl2 溶液中混有FeCl3杂质,则往往加入试剂
①NaOH ②NH3·H2O ③CuO ④CuCO3
(4)在酸碱滴定中,我们用0.1000mol/L HCl来滴定未知浓度的NaOH溶液,①在滴定过程中,操作或说法错误的是
a.滴定终点为:当滴完最后一滴恰好变色,且在半分钟内不恢复原色
b.进行中和滴定操作时,左手振荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
c.酸式滴定管中的盐酸装液前未经润洗,导致所测定的c(NaOH)偏低。
d.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致所测定的c(NaOH)偏高
②某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=
更新时间:2019-11-26 15:54:05
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】已知:在稀溶液中,酸和碱发生中和反应生成 水时的反应热叫做中和热。某同学将
水时的反应热叫做中和热。某同学将 盐酸与
盐酸与 溶液在如图所示的装置中进行反应,通过测定反应过程中的温度变化,可计算出中和热。请回答下列问题:
溶液在如图所示的装置中进行反应,通过测定反应过程中的温度变化,可计算出中和热。请回答下列问题:
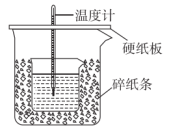
(1)量取盐酸和 溶液时用到的实验仪器是
溶液时用到的实验仪器是___________ 。
(2)上图实验装置存在两个缺陷,分别是___________ ,___________ 。
(3)若用铁片代替硬纸板,测得的中和热∆H___________ (填“偏大”“偏小”或“无变化”)。
(4)下列说法正确的是___________(填标号)。
(5)假设盐酸和 溶液的密度都是
溶液的密度都是 ,混合后溶液的比热容为
,混合后溶液的比热容为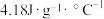 。该同学实验记录数据如下:
。该同学实验记录数据如下:
依据实验数据计算,该实验测得的中和热∆H=___________ (计算结果保留一位小数)。
(6)实验中改用 盐酸与
盐酸与 溶液进行反应,与上述实验相比,所测得的中和热∆H
溶液进行反应,与上述实验相比,所测得的中和热∆H___________ (填“偏大”“偏小”或“无变化”)。
 水时的反应热叫做中和热。某同学将
水时的反应热叫做中和热。某同学将 盐酸与
盐酸与 溶液在如图所示的装置中进行反应,通过测定反应过程中的温度变化,可计算出中和热。请回答下列问题:
溶液在如图所示的装置中进行反应,通过测定反应过程中的温度变化,可计算出中和热。请回答下列问题:
(1)量取盐酸和
 溶液时用到的实验仪器是
溶液时用到的实验仪器是(2)上图实验装置存在两个缺陷,分别是
(3)若用铁片代替硬纸板,测得的中和热∆H
(4)下列说法正确的是___________(填标号)。
| A.用温度计测量溶液温度时,温度计水银球不能接触容器壁和容器底 |
B.测量盐酸的起始温度之后,应将温度计用蒸馏水冲洗并用滤纸擦净,然后再测量 溶液的起始温度 溶液的起始温度 |
C.若不慎将 溶液溅到皮肤上,需用水冲洗干净,并涂抹3%~5% 溶液溅到皮肤上,需用水冲洗干净,并涂抹3%~5% 溶液 溶液 |
| D.实验结束后的废液可直接倒入下水道中排放 |
 溶液的密度都是
溶液的密度都是 ,混合后溶液的比热容为
,混合后溶液的比热容为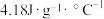 。该同学实验记录数据如下:
。该同学实验记录数据如下:| 序号 | 起始温度(T/℃) | 最高温度(T/℃) | |
| 盐酸 |  溶液 溶液 | 混合溶液 | |
| 1 | 20.0 | 20.0 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.3 | 20.1 | 23.5 |
(6)实验中改用
 盐酸与
盐酸与 溶液进行反应,与上述实验相比,所测得的中和热∆H
溶液进行反应,与上述实验相比,所测得的中和热∆H
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________ 。
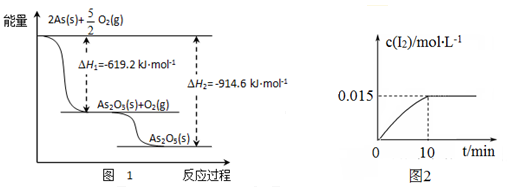
(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______ (填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d. 保持不再变化
保持不再变化
②0~10 min内,I−的反应速率v(I−)=_______ 。
③在该条件下,上述反应的平衡常数K=______ 。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______ 0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______ 。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______ (填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________ 。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式

(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+
 AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。①下列情况表明上述可逆反应达到平衡状态的是
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.
 保持不再变化
保持不再变化②0~10 min内,I−的反应速率v(I−)=
③在该条件下,上述反应的平衡常数K=
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g•mL-1。用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测醋酸是否符合国家标准。某兴趣小组检测某品牌白醋的过程如下。
I.实验步骤
①取10.00mL白醋,配制100.00mL溶液,取稀释后的溶液25.00mL于锥形瓶中待测。
②将0.0800mol•L-1NaOH标准液装入碱式滴定管中,并排除尖嘴处气泡,读数并记录。向锥形瓶中加入指示剂,开始滴定,达到终点时读数并记录。数据如表:
回答下列问题:
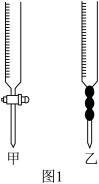
(1)取稀释后的溶液25.00mL用到的仪器是_____ (填图1中“甲”或“乙”)。
(2)选择_____ 溶液作指示剂,滴定终点的判断方法为_____ 。
II.数据处理
(3)白醋中醋酸含量为_____ g•mL-1。
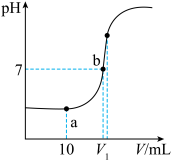
(4)滴定曲线如图2,a点时,溶液中离子浓度大小关系为_____ ;计算Ka(CH3COOH)=_____ mol•L-1(用含V1的表达式表示)。
III.误差分析
(5)下列操作中,会使所测白醋中醋酸的浓度偏低的是_____ (填标号)。
A.溶液转移至容量瓶后未洗涤烧杯和玻璃棒
B.碱式滴定管未用NaOH标准液润洗就直接注入NaOH溶液
C.锥形瓶用白醋稀溶液润洗
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
I.实验步骤
①取10.00mL白醋,配制100.00mL溶液,取稀释后的溶液25.00mL于锥形瓶中待测。
②将0.0800mol•L-1NaOH标准液装入碱式滴定管中,并排除尖嘴处气泡,读数并记录。向锥形瓶中加入指示剂,开始滴定,达到终点时读数并记录。数据如表:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 0.20 | 20.10 |
| 3 | 25.00 | 0.65 | 21.35 |
(1)取稀释后的溶液25.00mL用到的仪器是

(2)选择
II.数据处理
(3)白醋中醋酸含量为
(4)滴定曲线如图2,a点时,溶液中离子浓度大小关系为

III.误差分析
(5)下列操作中,会使所测白醋中醋酸的浓度偏低的是
A.溶液转移至容量瓶后未洗涤烧杯和玻璃棒
B.碱式滴定管未用NaOH标准液润洗就直接注入NaOH溶液
C.锥形瓶用白醋稀溶液润洗
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】NH3是一种重要的化工产品,是制造铵盐的原料。
(1) NH3的电子式 为____________ 。
(2)实验室用图1所示装置制备氨气,该反应的化学反应方程式为_______ ,检验氨气的方法是____________ 。

(3)实验室也常用图2所示的简易装置制备氨气,下列说法正确的是________ (填字母序号)。
a.锥形瓶中加入的固体物质可以是碱石灰
b.制得的氨气可用碱石灰来干燥
c.可用图3装置和试剂对氨气进行尾气处理
(4)氯化铵常用作除锈剂,用化学用语表达其水溶液呈酸性的原因是______ ;
(5)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇反应制取一氯甲烷,该反应的化学方程式为________ 。
(1) NH3的
(2)实验室用图1所示装置制备氨气,该反应的化学反应方程式为

(3)实验室也常用图2所示的简易装置制备氨气,下列说法正确的是
a.锥形瓶中加入的固体物质可以是碱石灰
b.制得的氨气可用碱石灰来干燥
c.可用图3装置和试剂对氨气进行尾气处理
(4)氯化铵常用作除锈剂,用化学用语表达其水溶液呈酸性的原因是
(5)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇反应制取一氯甲烷,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
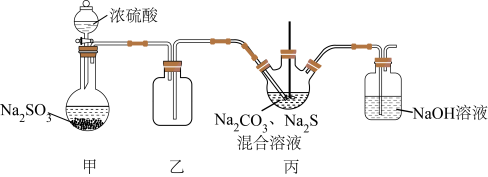
【推荐2】Na2S2O3的实验室制备装置图如下(加热和夹持装置略):
已知:i.2Na2S + 3SO2 = 2Na2SO3+ 3S↓、Na2SO3+ S=Na2S2O3
ii.硫单质在含乙醇的水溶液中析出时,颗粒更小,分布均匀
iii.氢硫酸和碳酸的电离常数如下表
(1)甲中发生反应的化学方程式为_______ 。
(2)丙中加入的试剂是物质的量比为2:1的Na2S和Na2CO3的混合溶液,pH约为13。制备过程中,向丙中通入SO2,澄清溶液先变浑浊,后变澄清,稍后又再次出现微量浑浊,此时立刻停止通入SO2,溶液经分离可得Na2S2O3。
①反应前,丙中混合溶液pH约为13的主要原因是_______ (用离子方程式表示)。
②加入Na2CO3的作用是_______ 。
③“稍后又再次出现微量浑浊”的原因_______ (用化学用语表示)。
④制备时,丙中往往还会加入少量乙醇,目的是_______ 。
⑤为了提高制备的效率,可将丙装置水浴加热。其它条件均相同时,水浴温度与反应达到终点的时间如下表所示:
最佳水浴温度为_______ 。继续提高水浴温度,达到终点的时间增加的原因是_______ 。
(3)实际工业生产中制得的Na2S2O3溶液中常混有少量Na2SO3,结合溶解度曲线(如图),获得Na2S2O3·5H2O的方法是_______ 。


已知:i.2Na2S + 3SO2 = 2Na2SO3+ 3S↓、Na2SO3+ S=Na2S2O3
ii.硫单质在含乙醇的水溶液中析出时,颗粒更小,分布均匀
iii.氢硫酸和碳酸的电离常数如下表
| Ka1 | Ka2 | |
| H2S | 1.1×10-7 | 1.3 ×10-13 |
| H2CO3 | 4.5×10-7 | 4.7×10-11 |
(2)丙中加入的试剂是物质的量比为2:1的Na2S和Na2CO3的混合溶液,pH约为13。制备过程中,向丙中通入SO2,澄清溶液先变浑浊,后变澄清,稍后又再次出现微量浑浊,此时立刻停止通入SO2,溶液经分离可得Na2S2O3。
①反应前,丙中混合溶液pH约为13的主要原因是
②加入Na2CO3的作用是
③“稍后又再次出现微量浑浊”的原因
④制备时,丙中往往还会加入少量乙醇,目的是
⑤为了提高制备的效率,可将丙装置水浴加热。其它条件均相同时,水浴温度与反应达到终点的时间如下表所示:
| 温度(℃) | 30 | 35 | 40 | 45 | 50 |
| 时间(min) | 41 | 34 | 20 | 30 | 42 |
(3)实际工业生产中制得的Na2S2O3溶液中常混有少量Na2SO3,结合溶解度曲线(如图),获得Na2S2O3·5H2O的方法是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】活性炭吸附法是工业提碘的主要方法之一,其流程如图:

完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I﹣氧化为I2,同时生成NO.写出反应①的离子方程式______ .
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I﹣选择了价格并不便宜的亚硝酸钠,可能的原因是______ .
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是______ .
(4)流程中,碘元素经过了I﹣→I2→I﹣、IO3﹣→I2的变化过程,这样反复操作的目的是______ .
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在以下两种程度不同的平衡体系:
①水解______ 和电离______ (用离子方程式表示)
②如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
加入少量Ba(OH)2固体,水解平衡向______ 移动;加入少量NaClO固体,溶液的pH______ (选填:增大、减小、不变).

完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I﹣氧化为I2,同时生成NO.写出反应①的离子方程式
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I﹣选择了价格并不便宜的亚硝酸钠,可能的原因是
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是
(4)流程中,碘元素经过了I﹣→I2→I﹣、IO3﹣→I2的变化过程,这样反复操作的目的是
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在以下两种程度不同的平衡体系:
①水解
②如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
加入少量Ba(OH)2固体,水解平衡向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】化学与生活息息相关,根据题目信息回答相关问题。
(1)痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
HUr(尿酸,aq) Ur-(尿酸根,aq)+H+(aq)(37°C时,Ka=4.0×10-6);NaUr(s)
Ur-(尿酸根,aq)+H+(aq)(37°C时,Ka=4.0×10-6);NaUr(s) Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
①37°C时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________ 。
②关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp_______ 。(填“增大”“减小”或“不变”),生成尿酸钠晶体的反应是________ (填“放热”或“吸热”)反应。
(2)常温下,有浓度均为0.1mol·L-1的下列4种溶液:①NaCN、②NaOH、③CH3COONa、④Na2CO3。
已知常温下某些酸的电离平衡常数如下表所示:
①常温下,这4种溶液pH由大到小的顺序是________ (用序号比较)。
②0.1mol·L-1NaOH与0.2mol·L-1HCN等体积混合,则c(HCN)________ c(CN-)(填“>”、“<”、“=”,下同)。
③若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③________ ④。
④25°C时,将amol·L-1的醋酸和0.1mol·L‑1NaOH溶液等体积混合后,溶液的pH=7,则a________ 0.1。
⑤Na2CO3溶液中离子浓度由大到小排序为:________ 。
⑥向NaCN溶液中通入少量CO2,则发生的离子反应方程式为:________ 。
(1)痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
HUr(尿酸,aq)
 Ur-(尿酸根,aq)+H+(aq)(37°C时,Ka=4.0×10-6);NaUr(s)
Ur-(尿酸根,aq)+H+(aq)(37°C时,Ka=4.0×10-6);NaUr(s) Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)①37°C时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为
②关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp
(2)常温下,有浓度均为0.1mol·L-1的下列4种溶液:①NaCN、②NaOH、③CH3COONa、④Na2CO3。
已知常温下某些酸的电离平衡常数如下表所示:
| HCN | H2CO3 | CH3COOH |
| Ka=5.0×10-10 | Ka1=4.4×10-7;Ka2=4.7×10-11 | Ka=1.8×10-5 |
②0.1mol·L-1NaOH与0.2mol·L-1HCN等体积混合,则c(HCN)
③若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
④25°C时,将amol·L-1的醋酸和0.1mol·L‑1NaOH溶液等体积混合后,溶液的pH=7,则a
⑤Na2CO3溶液中离子浓度由大到小排序为:
⑥向NaCN溶液中通入少量CO2,则发生的离子反应方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】(1)含11.2 g KOH的稀溶液与1 L0.1mol/L的H2SO4溶液反应放出11.46 kJ的热量,该反应表示中和热的热化学方程式为___________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g) 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
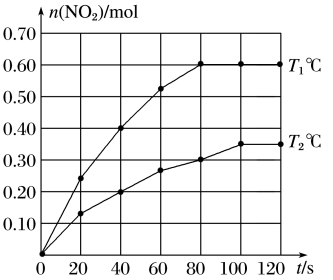
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为________ mol/(L·s)。
②ΔH________ 0(填“>”、“<”或“=”)。
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

①甲容器平衡后物质B的转化率为_______ ;
②T℃ 时该反应的平衡常数为________ 。
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显________ 性(填“酸”“碱”或“中”);
②用含a的代数式表示NH3·H2O的电离常数Kb=__________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g)
 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为
②ΔH
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)
 xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
①甲容器平衡后物质B的转化率为
②T℃ 时该反应的平衡常数为
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显
②用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为________ 。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1 H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式_______ 。
②c点时溶液中各离子浓度由大到小的顺序为______ 。
③b点时溶液中c(H2N2O2)________ (填“>”“<”或“=”,下同)c(N2 )。
)。
④a点时溶液中c(Na+)________ c(HN2 )+c(N2
)+c(N2 )。
)。
(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1 H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式
②c点时溶液中各离子浓度由大到小的顺序为
③b点时溶液中c(H2N2O2)
 )。
)。④a点时溶液中c(Na+)
 )+c(N2
)+c(N2 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
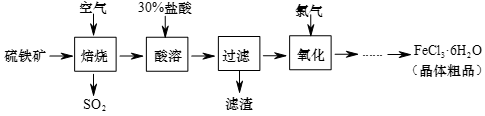
完成下列填空:
(1)焙烧产生的SO2可以继续制备硫酸,其中的反应之一为:2SO2+O2 2SO3+Q(Q>0),该反应的平衡常数表达式为K=
2SO3+Q(Q>0),该反应的平衡常数表达式为K=___________ ;欲使K值增大,可采取的措施是______________ 。若经一段时间后SO3的浓度增加了4mol/L,在这段时间内用O2表示的反应速率为0.4 mol/(L∙s),则这段时间为_______ (选填编号)。
a.1s b.5s c.10s d.50s
(2)硫铁矿焙烧后的烧渣中含有Fe2O3、Fe3O4等。酸溶后溶液中主要存在的阳离子有______________ ,不能用硫酸代替盐酸的原因是____________________________ 。
(3)通入氯气时,主要反应的离子方程式为________________________ 。从氧化后的溶液中得到氯化铁晶体的实验步骤为_______________ 、_______________ 、过滤洗涤。
(4)酸溶及后续过程中均需保持盐酸过量,请从水解平衡移动原理解释原因_________________________________________________________________________ 。

完成下列填空:
(1)焙烧产生的SO2可以继续制备硫酸,其中的反应之一为:2SO2+O2
 2SO3+Q(Q>0),该反应的平衡常数表达式为K=
2SO3+Q(Q>0),该反应的平衡常数表达式为K=a.1s b.5s c.10s d.50s
(2)硫铁矿焙烧后的烧渣中含有Fe2O3、Fe3O4等。酸溶后溶液中主要存在的阳离子有
(3)通入氯气时,主要反应的离子方程式为
(4)酸溶及后续过程中均需保持盐酸过量,请从水解平衡移动原理解释原因
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪的工艺流程如图1所示。回答下列问题:
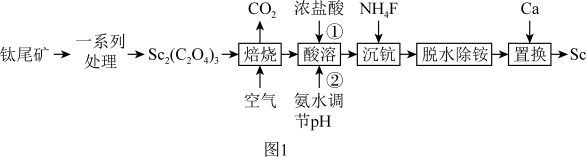
已知:xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的沉淀,在强酸中部分溶解。
(1)Sc元素在周期表中的位置_______ 。
(2)“焙烧”过程中使Sc2(C2O4)3充分氧化可采取的措施_______ ,_______ 。
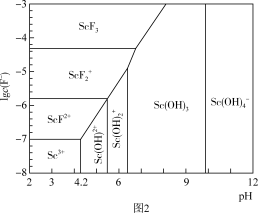
(3)含钪元素的微粒与lgc(F-)、pH的关系如下图2所示,用氨水调节溶液的pH,控制pH的范围是3.5<pH<<4.2,pH不能过高的原因是_______ 。
(4)xNH4Cl·yScF3·zH2O中存在的化学键类型有_______ 。
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
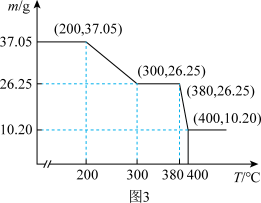
(5)“脱水除铵”是复盐沉淀(xNH4Cl·yScF3·zH2O)的热分解过程,其固体质量与温度的关系如图3所示。其中在380-400°C过程中会有白烟冒出,保温至无烟气产生,即得到ScF3。复盐沉淀(xNH4Cl·yScF3·zH2O)分解的总反应方程式为_______ 。
(6)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是_______ 。

已知:xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的沉淀,在强酸中部分溶解。
(1)Sc元素在周期表中的位置
(2)“焙烧”过程中使Sc2(C2O4)3充分氧化可采取的措施
(3)含钪元素的微粒与lgc(F-)、pH的关系如下图2所示,用氨水调节溶液的pH,控制pH的范围是3.5<pH<<4.2,pH不能过高的原因是

(4)xNH4Cl·yScF3·zH2O中存在的化学键类型有
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(5)“脱水除铵”是复盐沉淀(xNH4Cl·yScF3·zH2O)的热分解过程,其固体质量与温度的关系如图3所示。其中在380-400°C过程中会有白烟冒出,保温至无烟气产生,即得到ScF3。复盐沉淀(xNH4Cl·yScF3·zH2O)分解的总反应方程式为

(6)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】无水FeCl3是有机合成催化剂,还可做水处理剂等。实验室可用FeCl3·6H2O和亚硫酰氯(SOCl2)制备无水FeCl3,装置如图所示(加热及夹持装置略)。已知无水FeCl3能吸收空气里的水分而潮解;SOCl2沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
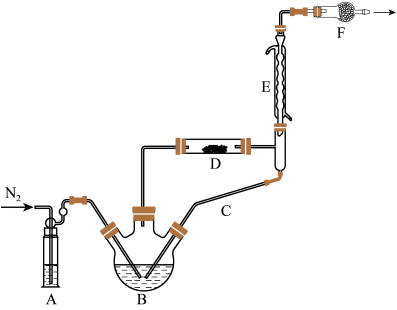
(1)仪器F的名称是___________ 。
(2)SOCl2遇水发生反应的化学方程式为___________ ,将FeCl3溶液蒸干灼烧得不到无水FeCl3,而将SOCl2与FeCl3·6H2O混合加热,可得到无水FeCl3,试解释原因:___________ 。
(3)反应后通入N2的目的是排出装置内的酸性气体,装置F中盛装的物质是___________ ,其作用为___________ 。
(4)为了检验D中最终产品是否含有FeCl2,取少量产品溶于盐酸,可证明产品中含有FeCl2的最佳试剂是___________(填标号)。

(1)仪器F的名称是
(2)SOCl2遇水发生反应的化学方程式为
(3)反应后通入N2的目的是排出装置内的酸性气体,装置F中盛装的物质是
(4)为了检验D中最终产品是否含有FeCl2,取少量产品溶于盐酸,可证明产品中含有FeCl2的最佳试剂是___________(填标号)。
| A.NaOH溶液 | B.铁氰化钾溶液 | C.酸性高锰酸钾溶液 | D.KSCN溶液 |
您最近一年使用:0次



