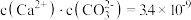下列选项正确的是( )
| A.25℃时,AgBr在0.0lmol/L的MgBr2溶液和NaBr溶液中的溶解度相同 |
B.53℃时,将0.01mol/L的醋酸溶液加水不断稀释, 减小 减小 |
| C.Na2CO3、NaHCO3溶液等浓度等体积混合后:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN) |
更新时间:2019-12-19 21:13:29
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】对于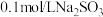 溶液,不正确的是
溶液,不正确的是
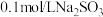 溶液,不正确的是
溶液,不正确的是A.升高温度,溶液 增大 增大 |
B.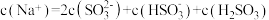 |
C.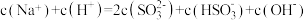 |
D.加入少量 固体, 固体,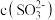 与 与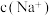 均增大 均增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】醋酸的电离方程式为CH3COOH(aq)⇌H+(aq)+CH3COO-(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液Ka=1.75×10-5(Ka表示酸的电离常数)。下列说法正确的是
| A.升高温度,c(H+)增大,Ka变大 |
| B.该溶液中加少量CH3COONa固体,平衡正向移动 |
| C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 |
| D.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,下列叙述不正确的是
A.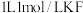 溶液中离子总数小于 溶液中离子总数小于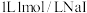 溶液中离子总数 溶液中离子总数 |
B.向 的硫酸中加水至原体积的10000倍,有 的硫酸中加水至原体积的10000倍,有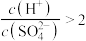 |
C.等物质的量浓度的① ;② ;② ;③ ;③ ;④ ;④ 四种溶液,溶液中 四种溶液,溶液中 :③>①>②>④ :③>①>②>④ |
D.将等物质的量的 和 和 混合溶于水中,形成的溶液有 混合溶于水中,形成的溶液有 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知:碳酸的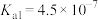 ,
, ;次氯酸的
;次氯酸的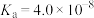 ;氢硫酸的
;氢硫酸的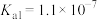 ,
,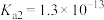 。下列说法错误的是
。下列说法错误的是
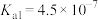 ,
, ;次氯酸的
;次氯酸的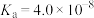 ;氢硫酸的
;氢硫酸的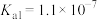 ,
,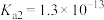 。下列说法错误的是
。下列说法错误的是A.向漂白粉的溶液中通入少量 的化学方程式: 的化学方程式: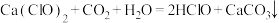 |
B.室温下, 溶液的pH大于等浓度的 溶液的pH大于等浓度的 溶液 溶液 |
C.向漂白液中通入少量 的离子方程式: 的离子方程式: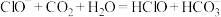 |
D.NaHS溶液中存在: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
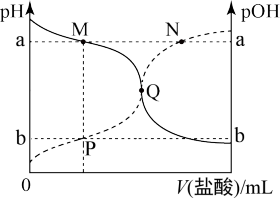
【推荐1】常温下,向20 mL0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中c(OH-)与所加NaOH溶液的体积(V)的关系如图所示。下列说法不正确的是
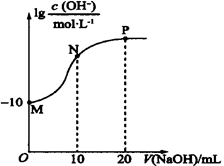

| A.常温下,Ka(HA)≈1.0×10-6 |
| B.N点溶液中存在:c(Na+)+c(H+)=c(A-)+c(OH-) |
| C.P点后的溶液中均存在:c(Na+)>c(A-)>c(OH-)>c(H+) |
| D.水的电离程度:M<N<P |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】《本草纲目》中对白矾之用有如下叙述:“吐利风热之痰涎,取其酸苦涌泄也,治诸血痛脱肛阴挺疮疡,取其酸涩而收也……”。已知白矾的主要化学成分为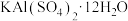 。下列说法正确的是
。下列说法正确的是
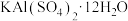 。下列说法正确的是
。下列说法正确的是| A.白矾能治血痛是利用了胶体的吸附作用 |
B.白矾溶于水后微粒浓度的大小关系为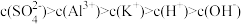 |
| C.白矾和氯化铁均可用作水处理剂,均可杀菌消毒 |
D.白矾常用于油条中作膨化剂的原理是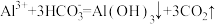 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列离子方程式书写不正确的是:
A.Mg(HCO3)2 溶液与足量的 NaOH 溶液反应: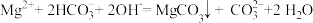 |
B.向含氯化铁的氯化镁溶液中加入氧化镁: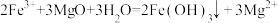 |
C.FeCl3 溶液吸收足量 H2S: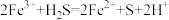 |
D.1mol/L NaAlO2 溶液和 2.5mol/L HCl 溶液等体积混合: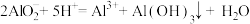 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】在一定温度下将适量AgBr固体加入水中,存在平衡: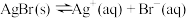 。则下列说法正确的是
。则下列说法正确的是
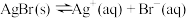 。则下列说法正确的是
。则下列说法正确的是| A.向此体系中滴加足量浓NaCl溶液,发现淡黄色固体转化为白色,说明Ksp(AgCl)<Ksp(AgBr) |
| B.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)均增大 |
C.此体系中一定存在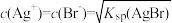 |
D.某溶液中 ,说明此时 ,说明此时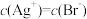 |
您最近一年使用:0次

 的值减小
的值减小 )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO )
)
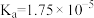 。下列说法错误的是
。下列说法错误的是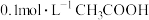 溶液的pH在2-3范围内
溶液的pH在2-3范围内 溶液中,
溶液中,
 溶液加水稀释,其电离常数和
溶液加水稀释,其电离常数和 均不变
均不变 溶液和
溶液和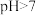 ,且
,且
 蒸馏水中加入
蒸馏水中加入 (
(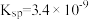 )粉末(足量),经过
)粉末(足量),经过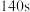 后往溶液中加入
后往溶液中加入 粉末(忽略温度变化),整个过程中溶液的导电率和
粉末(忽略温度变化),整个过程中溶液的导电率和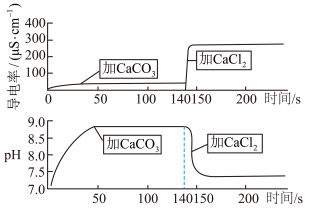
 粉末后,溶液中存在
粉末后,溶液中存在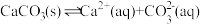
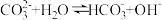
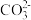 水解程度减弱
水解程度减弱