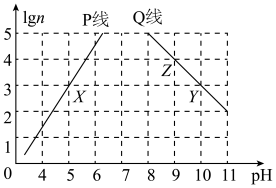
25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是


| A.HA一定是弱酸 |
| B.BOH可能是强碱 |
| C.z点时,水的电离被促进 |
| D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+) |
更新时间:2019-12-23 15:23:51
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】下列说法中正确的是
| A.在纯水中,c(H+) = c(OH-) = 10-7 mol/L,呈中性 |
| B.常温下溶液中,若c(H+) > 10-7 mol/L,则c(H+) > c(OH-),呈酸性 |
| C.c(H+)越大,则pH越大,溶液的碱性越强 |
| D.pH为0的溶液,其中只有H+而无OH- |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中:Al3+、Fe3+、 、S2- 、S2- |
B.含0.1 mol·L−1的FeCl2溶液中:H+、Al3+、 、 、 |
C.加入Al单质生成气体的溶液:Na+、 、 、 、Cl − 、Cl − |
D.常温下,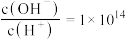 的溶液中:K+、Na+、I−、 的溶液中:K+、Na+、I−、 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】25℃时,向VmL  的NaOH溶液中,滴加10VmL
的NaOH溶液中,滴加10VmL  的稀硫酸,所得溶液中
的稀硫酸,所得溶液中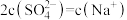 ,则
,则 的值是
的值是
 的NaOH溶液中,滴加10VmL
的NaOH溶液中,滴加10VmL  的稀硫酸,所得溶液中
的稀硫酸,所得溶液中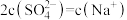 ,则
,则 的值是
的值是| A.13 | B.14 | C.15 | D.无法确定 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】常温下,甲、乙两烧杯均盛有 V1L pH=11NaOH溶液。将 V2L pH=3的一元强酸HA 溶液和 V3LpH=3的一元弱酸HB溶液分别加入甲、乙两烧杯中,均恰好完全反应。下列说法正确的是
| A.V3>V2=V1 | B.反应后:pH甲>pH乙 |
| C.甲烧杯中:c(Na+)<c(A-) | D.乙烧杯中:c(OH-)=c(HB)+c(H+) |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列表述正确的是
| A.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| B.中和等体积、等pH的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同 |
| C.pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中:c(H+)+c(M+)=c(OH-)+c(A-) |
D.在水电离出的H+浓度为1×10-12 mol/L的溶液中,K+、Mg2+、 、I-一定能大量共存 、I-一定能大量共存 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】已知NA为阿伏加德罗常数的值,下列说法正确的是
| A.一定条件下,1 mol H2与足量碘蒸汽充分反应,转移电子总数为2NA |
B.C4H8和C3H6的混合物的质量为a g,所含C—H键数目为 |
| C.常温下,56 g铁片与足量浓硫酸反应生成NA个SO2分子 |
D.常温常压下,将22.4 L NH3通入足量水中,溶液中N(NH3)+N(NH )+N(NH3·H2O) =NA )+N(NH3·H2O) =NA |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】常温,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5,下列说法正确的是
A.c(NH )相等的HCOONH4溶液、CH3COONH4溶液、NH4HCO3溶液:c(NH4HCO3)<c(CH3COONH4)<c(HCOONH4) )相等的HCOONH4溶液、CH3COONH4溶液、NH4HCO3溶液:c(NH4HCO3)<c(CH3COONH4)<c(HCOONH4) |
| B.浓度均为0.1 mol·L-1的HCOONa和NH4Cl两种溶液:c(OH-)+c(HCOO-)>c(H+)+c(NH4+) |
| C.0.1 mol·L-1的CH3COOH与0.05 mol·L-1 NaOH溶液等体积混合:c(H+)+c(CH3COOH)<c(OH-)+c(Na+) |
| D.向0.1 mol·L-1 CH3COONa溶液中通HCl至溶液pH=7:c(Na+)>c(CH3COOH)>c(Cl-) |
您最近一年使用:0次