已知: ,
,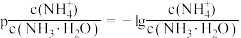 。
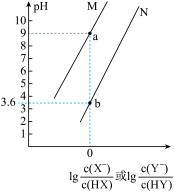
。 时,向
时,向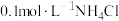 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
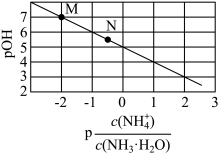
 ,
,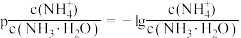 。
。 时,向
时,向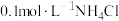 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是 
A.M点溶液中: |
B.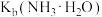 的数量级为 的数量级为 |
C.M点到N点: 的值不变 的值不变 |
D.N点: |
更新时间:2019-12-27 23:28:01
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,亚砷酸(H3AsO3)水溶液中含砷的各种微粒的分布分数(平衡时某物质的物质的量浓度占各物质的物质的量浓度之和的分数)随pH的变化如图所示。下列说法正确的是( )
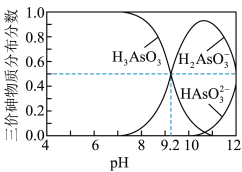

A.以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为:H3AsO3+2OH-=HAsO +2H2O +2H2O |
| B.Ka1(H3AsO3)的数量级为10-10 |
C.若将亚砷酸溶液如水稀释,则稀释过程中 减小 减小 |
D.PH=11时,溶液中有c(H2AsO )+2c(HAsO )+2c(HAsO )+c(OH-)=c(H+) )+c(OH-)=c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】若已知反应 NaNO2+HF=HNO2+NaF,7.2×10-4、 4.6 ×10-4分别是上式所涉及的两种酸的电离常数。由此可判断下列叙述中不正确的是( )
| A.K(HF)=c(F-)·c(H+)/c(HF ) | B.K(HNO2)=7.2×10-4 |
| C.酸性强弱为 HF> HNO2 | D.K(HNO2) < K(HF) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,在含有0.10mol/LH3PO3的溶液中,含磷元素的微粒pc随pOH的变化关系如图所示。已知 ,
,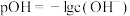 ,H3PO3为二元弱酸,下列有关说法中错误的是
,H3PO3为二元弱酸,下列有关说法中错误的是
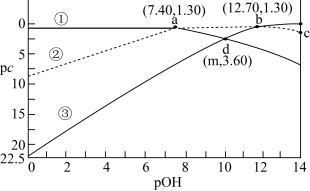
 ,
,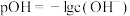 ,H3PO3为二元弱酸,下列有关说法中错误的是
,H3PO3为二元弱酸,下列有关说法中错误的是
A.曲线②代表 | B.H3PO3的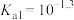 、 、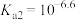 |
| C.NaHPO3溶液显碱性 | D.c点对应的溶液中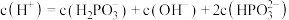 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列物质的性质与用途具有对应关系的是
A. 受热易分解,可用作氮肥 受热易分解,可用作氮肥 |
B. 的熔点高,可用作光纤通信材料 的熔点高,可用作光纤通信材料 |
C. 的水溶液显碱性,可用于除铁屑上的油污 的水溶液显碱性,可用于除铁屑上的油污 |
| D.石墨具有导电性,可用作铅笔的笔芯材料 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法中,正确的是
A.向0.1 mo/L的氨水中加入少量硫酸铵固体,则溶液中 增大 增大 |
B.常温下,0.1 mo/L的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,其中c( )由大到小的顺序是:① > ② > ③ )由大到小的顺序是:① > ② > ③ |
| C.在25℃时.将pH = l1的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后:c(Na+) > c(CH3COO-) > c(OH-) > c(H+) |
D.Na2CO3溶液中:2c(Na+) = c( ) + c( ) + c( ) + c(H2CO3) ) + c(H2CO3) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)、②NH4Cl、③CH3COONH4、④NH3·H2O;c( )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④ |
| B.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14 |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
D.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,Ksp减少 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,Ksp减少 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,浓度均为 的4种钠盐溶液pH如下:下列说法不正确的是( )
的4种钠盐溶液pH如下:下列说法不正确的是( )
 的4种钠盐溶液pH如下:下列说法不正确的是( )
的4种钠盐溶液pH如下:下列说法不正确的是( )| 溶质 |  |  | NaClO |  |
| pH |  | 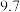 | 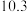 | 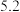 |
A.四种溶液中, 溶液中水的电离程度最大 溶液中水的电离程度最大 |
B. 溶液显酸性的原因是: 溶液显酸性的原因是: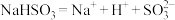 |
C.向氯水中加入少量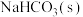 ,可以增大氯水中次氯酸的浓度 ,可以增大氯水中次氯酸的浓度 |
D.常温下,相同物质的量浓度的 、 、 、HClO,pH最小的是 、HClO,pH最小的是 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液 pH 关系如图所示。下列说法不正确的是
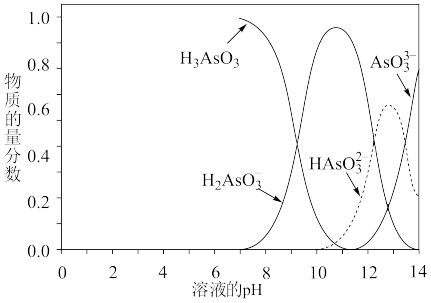

A.当 n(H3AsO3):n(H2AsO )=1:1 时,溶液呈碱性 )=1:1 时,溶液呈碱性 |
B.pH=12 时,溶液中c(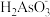 )+2c(HAsO )+2c(HAsO )+3c(AsO )+3c(AsO )+c(OH-)=c(H+) )+c(OH-)=c(H+) |
C.在K3AsO3 溶液中,c(AsO )>c(HAsO )>c(HAsO )>c(H2AsO )>c(H2AsO ) ) |
D. H2AsO 在溶液中,其水解程度大于电离程度 在溶液中,其水解程度大于电离程度 |
您最近一年使用:0次

 溶液分别滴加到
溶液分别滴加到 相同、等体积的
相同、等体积的 溶液和
溶液和 溶液中,溶液的
溶液中,溶液的 ,
, ,
,
 的变化关系
的变化关系 约为
约为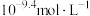
 的数目大于其中含有的酸分子的数目
的数目大于其中含有的酸分子的数目 ,
,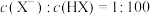
 溶液和
溶液和 溶液的
溶液的 固体,溶液红色变浅
固体,溶液红色变浅 浓度均为
浓度均为 的
的 混合溶液中加入
混合溶液中加入 溶液,出现白色沉淀
溶液,出现白色沉淀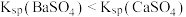
 的
的 和
和 两种酸分别与足量
两种酸分别与足量 反应,
反应, 多
多 的电离平衡常数为
的电离平衡常数为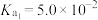 ,
,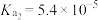 ,下列有关常温下
,下列有关常温下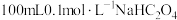 溶液的说法正确的是
溶液的说法正确的是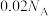

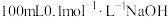 溶液后,溶液显酸性
溶液后,溶液显酸性

