常温下,下列有关离子浓度之间的关系不正确的是
| A.将CO2通入0.1mol/LNa2CO3溶液至中性(忽略溶液体积变化),溶液中:2c(CO32-)+c(HCO3-)=0.2mol/L |
| B.在0.1mol/LNaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO42-) |
| C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后pH=5,则混合溶液中:c(Na+)>c(CH3COO-) |
| D.已知Ka(CH3COOH)=Kb(NH3·H2O),则常温下0.1mol/LCH3COONH4中:c(CH3COO-)=c(NH4+) |
更新时间:2020-01-06 18:51:29
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知25℃时,H2SO3 的电离常数Ka1=1.23 10-2,Ka2=5.6
10-2,Ka2=5.6 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98 10-8,下列说法错误的是
10-8,下列说法错误的是
 10-2,Ka2=5.6
10-2,Ka2=5.6 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98 10-8,下列说法错误的是
10-8,下列说法错误的是| A.常温下,相同浓度的H2SO3 比HClO酸性强 |
| B.常温下,将NaHSO3溶液滴入到NaClO溶液中发生反应:HSO3-+ClO-=SO32-+HClO |
| C.常温下,NaHSO3溶液中HSO3-的电离程度大于其水解程度,NaHSO3溶液呈酸性 |
| D.将pH=5的HClO溶液加水稀释到pH=6时,溶液中部分离子浓度会升高 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】一定浓度的柠檬酸(用H3R表示)溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是





| A.Na3R溶液中存在的阴离子是HR2-、R3- |
| B.pH=4.8时,c(H2R-)=c(HR2-)>c(OH-)>c(H+) |
| C.H3R的第三步电离常数Ka3(H3R)的数量级为10-6 |
| D.pH=4时,c(H+)==c(H2R-)+c(HR2-)+c(OH-)+c(R3-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】有四种物质的量浓度相同且由一价阳离子A+、B+和一价阴离子X-、Y-组成的盐溶液,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH<7,BX的溶液的pH>7。则可能不水解的盐是
| A.AX | B.BX | C.AY | D.BY |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A |  溶液可用于除锈 溶液可用于除锈 |  易溶于水 易溶于水 |
| B | 往苯酚悬浊液中滴加 溶液,溶液变澄清 溶液,溶液变澄清 | 酸性:苯酚 |
| C |  常用于杀菌消毒 常用于杀菌消毒 |  受热易分解 受热易分解 |
| D | 乙醇与浓硫酸共热产生的气体能使酸性 溶液褪色 溶液褪色 | 乙醇可发生取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】25 ℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1 NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
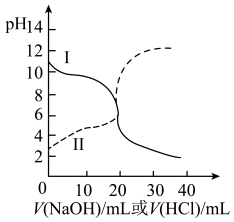

| A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅰ:滴加溶液到20 mL时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某溶液可能含有K+、 、Ca2+、Cl-、
、Ca2+、Cl-、 、
、 中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法不正确的是( )
中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法不正确的是( )
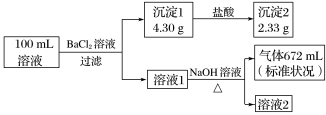
 、Ca2+、Cl-、
、Ca2+、Cl-、 、
、 中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法不正确的是( )
中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法不正确的是( )
A.原溶液中一定存在 、 、 和 和 |
| B.原溶液中一定不存在Ca2+,无法判断Cl-是否存在 |
| C.要确定Cl-是否存在,可取少许溶液2加入硝酸银和稀硝酸检验 |
| D.原溶液中c(K+)≥0.1mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】“石碱”的主要成分是 。下列说法
。下列说法不正确 的是
 。下列说法
。下列说法A.石碱溶液中: |
B.石碱溶液中: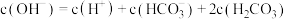 |
C.热石碱溶液除油污的原理是油脂直接与 反应 反应 |
D.“石碱”与强酸反应有 气体生成 气体生成 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,盐酸与氨水混合后,所得溶液 pH=7,则此溶液中存在( )
| A.该溶液的溶质为 NH4Cl |
| B.c(NH4+)+c(NH3·H2O)= c(Cl- ) |
| C.c(NH4+)< c(Cl- ) |
| D.c(NH4+ )+ c(OH-)=c(Cl- )+ c(H+) |
您最近一年使用:0次






 、
、 、
、 结合
结合 的能力,由强到弱的顺序为:
的能力,由强到弱的顺序为: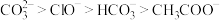

 溶液中通入少量
溶液中通入少量
 溶液中:
溶液中: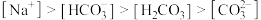
 产品中是否存在
产品中是否存在
 溶液
溶液 胶体
胶体 溶液中
溶液中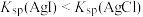
 溶液中先滴入5滴
溶液中先滴入5滴 的
的 溶液,再滴入5滴
溶液,再滴入5滴 溶液
溶液 的
的 的盐酸(或
的盐酸(或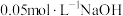 溶液),溶液的
溶液),溶液的 随加入酸(或碱)体积的变化如图所示。下列说法正确的是
随加入酸(或碱)体积的变化如图所示。下列说法正确的是
 过程中:
过程中: 逐渐减小
逐渐减小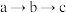 过程中:
过程中:
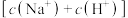 的值:
的值: 点小于
点小于 点
点

