 时,将一定量的冰醋酸
时,将一定量的冰醋酸 即无水乙酸
即无水乙酸 加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是
加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是
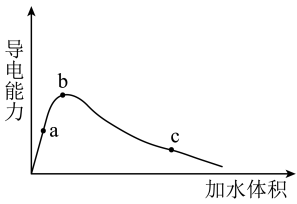
A.醋酸的电离平衡常数: |
B.溶液中 : : |
C.a、b、c三点的溶液都有: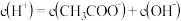 |
| D.从c点到b点,醋酸的电离度不断增大 |
更新时间:2020-02-09 12:18:29
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】浓度均为 、体积均为
、体积均为 的
的 和
和 溶液,分别加水稀释至体积为V,
溶液,分别加水稀释至体积为V, 随
随 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
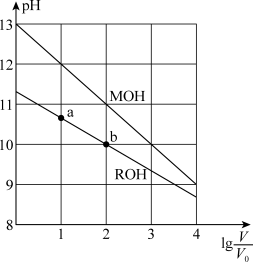
 、体积均为
、体积均为 的
的 和
和 溶液,分别加水稀释至体积为V,
溶液,分别加水稀释至体积为V, 随
随 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
A. 的碱性弱于 的碱性弱于 的碱性 的碱性 |
B. 的电离程度:b点小于a点 的电离程度:b点小于a点 |
C.若两溶液无限稀释,则它们的 相等 相等 |
D.当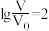 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则 增大 增大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,下列说法正确的是
| A.分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH |
B. 的 的 溶液加水稀释 溶液加水稀释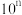 倍后, 倍后,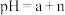 |
C.pH相等的 、NaOH溶液中,水的电离程度相同 、NaOH溶液中,水的电离程度相同 |
D. 溶液中: 溶液中: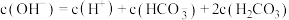 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是( )
A.向含有相等物质的量的 、ClO-、 、ClO-、 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 、ClO-、 、ClO-、 |
| B.向含有0.4molFeI2的溶液中通入0.3molCl2充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2 |
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+ |
D.向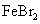 溶液中滴加少量氯水,再加入 溶液中滴加少量氯水,再加入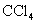 溶液振荡,静置,有机层呈橙色 溶液振荡,静置,有机层呈橙色 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】 时,向
时,向 中不断滴入
中不断滴入 ,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是
,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是 已知:
已知: 时一元酸
时一元酸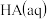 电离平衡常数
电离平衡常数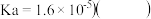

 时,向
时,向 中不断滴入
中不断滴入 ,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是
,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是 已知:
已知: 时一元酸
时一元酸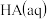 电离平衡常数
电离平衡常数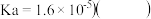

| A.a点溶液的pH大于3 |
B.b点溶液中离子: |
C.c点表示酸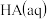 和 和 溶液恰好完全反应 溶液恰好完全反应 |
D.d点溶液加水稀释后 的值会增大 的值会增大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
A.t℃时,某溶液 ,则该溶液一定为酸性 ,则该溶液一定为酸性 |
B.常温下,将 的氨水稀释后,溶液中所有离子浓度均降低 的氨水稀释后,溶液中所有离子浓度均降低 |
C.常温下,将 的氢氧化钠溶液和 的氢氧化钠溶液和 的醋酸溶液等体积混合后,溶液 的醋酸溶液等体积混合后,溶液 |
D.等浓度的盐酸和氨水等体积混合后 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】设NA为阿伏加 德罗常数的值。关于常温下pH=2的H3PO4溶液,下列说法不正确的是
| A.加入NaH2PO4固体,溶液酸性增强 |
| B.每升溶液中的H+数目为0.01NA |
| C.加水稀释使H3PO4电离程度增大,溶液pH增大 |
D.c(H+)=c( )+2c( )+2c( )+3c( )+3c( )+c(OH-) )+c(OH-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】室温下,下列溶液中粒子浓度关系正确的是
| A.0.01mol·L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) |
| B.0.1 mol·L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) |
| C.等物质的量的NH4Cl和NaCl的混合溶液:c(NH4) +c(NH3·H2O)+c(Na+)=2c(Cl-) |
| D.c(H+)/c(OH-)=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12) mol·L-1 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】G是一种有机碱,溶于水成碱性的原理:G+H2O GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
 GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是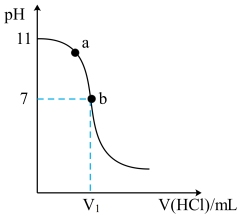
| A.G的近似电离常数是1×10-21 |
| B.V1>10 mL |
| C.水的电离程度:a<b |
| D.V(HCl)=20 mL 时,c(GH+)+c(G)=c(Cl-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐3】25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)关系如图所示,下列说法不正确的是
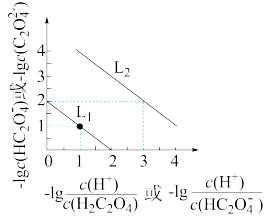

| A.曲线L1表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的关系 |
| B.Ka2(H2C2O4)的数量级为10-2 |
| C.已知NaHC2O4溶液的pH<7,则溶液中c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) |
| D.向0.1mol/L H2C2O4溶液中加入少量水[c(HC2O4-)/c(H2C2O4)]增大 |
您最近半年使用:0次

 CH3COO-+H+,Ka=1.75×10-5。以下说法正确的是
CH3COO-+H+,Ka=1.75×10-5。以下说法正确的是 值增大
值增大 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用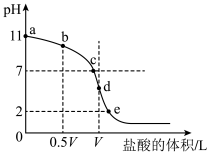

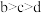
 的电离常数
的电离常数


