回答下列问题:
(1) 溶液显酸性,试用离子方程式解释其原因
溶液显酸性,试用离子方程式解释其原因________ 。
(2)氯化银在水中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl-(aq),在25C时,氯化银的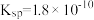 ,现将足量氯化银分别放入:①
,现将足量氯化银分别放入:①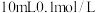 氯化镁溶液中,②
氯化镁溶液中,②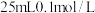 硝酸银溶液中,③
硝酸银溶液中,③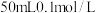 氯化铝溶液中,④
氯化铝溶液中,④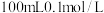 盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是
盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________ (填写序号)。
(3)下表所示的是常温下,某些弱酸的电离常数,请根据要求作答。
①相同物质的量浓度的 和
和 的混合溶液中离子浓度由大到小的顺序为
的混合溶液中离子浓度由大到小的顺序为_________ 。
②请判断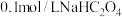 溶液显
溶液显_________ 性(填“酸”、“碱”或“中”)。
③下列离子方程式书写正确的是_______ 。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
(1)
 溶液显酸性,试用离子方程式解释其原因
溶液显酸性,试用离子方程式解释其原因(2)氯化银在水中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl-(aq),在25C时,氯化银的
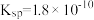 ,现将足量氯化银分别放入:①
,现将足量氯化银分别放入:①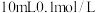 氯化镁溶液中,②
氯化镁溶液中,②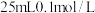 硝酸银溶液中,③
硝酸银溶液中,③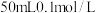 氯化铝溶液中,④
氯化铝溶液中,④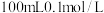 盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是
盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是(3)下表所示的是常温下,某些弱酸的电离常数,请根据要求作答。
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
 |  |  |  |
 | 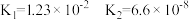 |  | 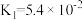 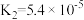 |
①相同物质的量浓度的
 和
和 的混合溶液中离子浓度由大到小的顺序为
的混合溶液中离子浓度由大到小的顺序为②请判断
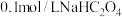 溶液显
溶液显③下列离子方程式书写正确的是
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
更新时间:2020-03-26 22:04:01
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka___________ 填“增大”、“减小”或“不变”。
(2)下列四种离子结合质子能力由大到小的顺序是___________ 填序号;
a.CO b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是___________ 填序号
a.CO +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=2ClO-+CO2↑+H2O
+2HClO=2ClO-+CO2↑+H2O
d.2ClO-+CO2+H2O=CO +2HClO
+2HClO
(4)用蒸馏水稀释0.10mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___________ 填序号;
a. b.
b. c.
c.
| 化学式 |  |  | HClO |
| 电离平衡常数 | 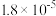 |  , ,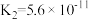 | 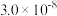 |
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO
 b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是
a.CO
 +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2Ob.ClO-+CH3COOH=CH3COO-+HClO
c.CO
 +2HClO=2ClO-+CO2↑+H2O
+2HClO=2ClO-+CO2↑+H2Od.2ClO-+CO2+H2O=CO
 +2HClO
+2HClO(4)用蒸馏水稀释0.10mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是
a.
 b.
b. c.
c.
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液显酸性,用离子方程式表示原因 +H2O
+H2O NH3·H2O+H+,其溶液中离子浓度大小顺序为
NH3·H2O+H+,其溶液中离子浓度大小顺序为 ________________ 。
(2)常温下,pH=11的CH3COONa溶液中,由水电离出来的c(OH-)=_____ ,在pH=3的CH3COOH溶液中,由水电离出来的c(H+)= __________ 。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 ________ (填字母序号)。
A.向水中加入NaHSO4固体
B.向水中加入Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10−6 mol·L−1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m_______ (填“<”“>”或“=”)n。
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序排列为:_____ (填序号)。
(1)NH4Cl溶液显酸性,用离子方程式表示原因
 +H2O
+H2O NH3·H2O+H+,其溶液中离子浓度大小顺序为
NH3·H2O+H+,其溶液中离子浓度大小顺序为 (2)常温下,pH=11的CH3COONa溶液中,由水电离出来的c(OH-)=
(3)已知纯水中存在如下平衡:H2O+H2O
 H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 A.向水中加入NaHSO4固体
B.向水中加入Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10−6 mol·L−1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序排列为:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1)常温下,0.1 mol/LNaHB溶液中存在的离子有: 、
、 、
、 、
、 、
、 ,存在的分子
,存在的分子只有  ;且
;且 ,则
,则 的电离方程式
的电离方程式___________ 。
(2) 时,已知0.1 mol/LHCl溶液中
时,已知0.1 mol/LHCl溶液中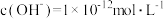 ,现将0.2 mol/L的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=
,现将0.2 mol/L的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=___________ 。
(3)25℃时,部分物质的电离平衡常数如下表所示:
下列微粒能大量共存的是___________ 。
A. 、
、 B.
B. 、
、
C. 、
、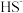 D.
D. 、CH3COO-
、CH3COO-
(4)常温下,等物质的量浓度的 、
、 、
、 三种溶液的pH由小到大的顺序是
三种溶液的pH由小到大的顺序是___________ 。
 、
、 、
、 、
、 、
、 ,存在的分子
,存在的分子 ;且
;且 ,则
,则 的电离方程式
的电离方程式(2)
 时,已知0.1 mol/LHCl溶液中
时,已知0.1 mol/LHCl溶液中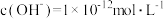 ,现将0.2 mol/L的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=
,现将0.2 mol/L的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=(3)25℃时,部分物质的电离平衡常数如下表所示:
| 弱酸化学式 |  |  |  |
| 电离平衡常数 |  |   | 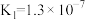 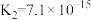 |
下列微粒能大量共存的是
A.
 、
、 B.
B. 、
、
C.
 、
、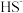 D.
D. 、CH3COO-
、CH3COO-(4)常温下,等物质的量浓度的
 、
、 、
、 三种溶液的pH由小到大的顺序是
三种溶液的pH由小到大的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】农业生产离不开空气、水、土壤和肥料,保护土壤资源,防止土壤污染,改良土壤酸碱性是保证社会可持续发展的重要工作。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:_______ 。
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。_______ ;_______ 。
(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):_______ 。
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):_______ 。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中
 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题:
(1)写出碳酸的第二步电离平衡常数表达式Ka2_______ 。
(2)将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是_______ 。
(3)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_______ 。
(4)NaClO溶液中的电荷守恒关系为_______ 。
(1)写出碳酸的第二步电离平衡常数表达式Ka2
(2)将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是
(3)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(4)NaClO溶液中的电荷守恒关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】食醋(约含3%~5%的CH3COOH)、纯碱(Na2CO3)和84消毒液(主要成分为NaClO)是生活中常见的化学用品,回答下列问题:
(1)醋酸(CH3COOH)属于___________ 电解质(填“强”、“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因___________ 。
(2)用离子方程式表示纯碱溶液呈碱性的原因___________ 。
(3)将少量NaOH溶液滴入醋酸溶液中,溶液中 的值变化趋势为
的值变化趋势为___________ (填“增大”、“减小”或“不变”)。
(4)常温下,pH=4的醋酸溶液与pH=10的纯碱溶液中,水电离出的c(OH-)之比为___________ 。
(1)醋酸(CH3COOH)属于
(2)用离子方程式表示纯碱溶液呈碱性的原因
(3)将少量NaOH溶液滴入醋酸溶液中,溶液中
 的值变化趋势为
的值变化趋势为(4)常温下,pH=4的醋酸溶液与pH=10的纯碱溶液中,水电离出的c(OH-)之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】请回答下列问题(25 ℃时):
⑴若向0.1 mol·L-1氨水中加入少量硫酸铵固体,此时溶液中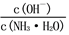
________ (填“增大”、“减小”或“不变”)。
⑵若向0.1 mol·L-1氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:_______________________________ ;所得溶液的pH______ 7(填“>”、“<”或“=”),用离子方程式表示其原因_____________________________________ 。
⑶若向0.1 mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH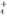 )=a mol·L-1,则c(SO
)=a mol·L-1,则c(SO )为
)为__________________ 。
⑷若向0.1 mol·L-1氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是____________________________ 。
⑸将足量的AgCl固体分别放入:①5 mL水,②10 mL 0.2 mol·L-1 MgCl2溶液,③20 mL 0.5 mol·L-1 NaCl溶液,④40 mL 0.1 mol·L-1盐酸中溶解至溶液饱和,各溶液中Ag+的物质的量浓度分别为a、b、c、d,它们由大到小的排列顺序是____________________ 。
⑴若向0.1 mol·L-1氨水中加入少量硫酸铵固体,此时溶液中
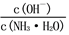
⑵若向0.1 mol·L-1氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:
⑶若向0.1 mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH
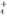 )=a mol·L-1,则c(SO
)=a mol·L-1,则c(SO )为
)为⑷若向0.1 mol·L-1氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是
⑸将足量的AgCl固体分别放入:①5 mL水,②10 mL 0.2 mol·L-1 MgCl2溶液,③20 mL 0.5 mol·L-1 NaCl溶液,④40 mL 0.1 mol·L-1盐酸中溶解至溶液饱和,各溶液中Ag+的物质的量浓度分别为a、b、c、d,它们由大到小的排列顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:_______________ 。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是_______ (填字母序号)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
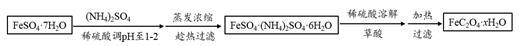
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
①用稀硫酸调溶液pH至1~2的目的是:_____________ ,______________ 。
②趁热过滤的原因是:_______________ 。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M =__________ 。(已知:部分反应产物为Mn2+、Fe3+、CO2)
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
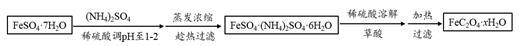
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
| FeSO4·7H2O | (NH4)2SO4 | FeSO4·(NH4)2SO4·6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
①用稀硫酸调溶液pH至1~2的目的是:
②趁热过滤的原因是:
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M =
您最近一年使用:0次

 难溶于水,但可溶于含
难溶于水,但可溶于含 的溶液中,原因是
的溶液中,原因是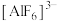 在溶液中可稳定存在)。
在溶液中可稳定存在)。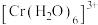 中,与
中,与 形成配位键的原子是
形成配位键的原子是

