(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是____ (填“I”或“II”)。
②V1和V2的关系:V1____ V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是____ 。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
①写出步骤2中溶液变红色的离子方程式____ 。
②步骤3中现象a是____ 。
③用化学平衡原理解释步骤4的实验现象____ 。

①滴定醋酸的曲线是
②V1和V2的关系:V1
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
| 操作步骤 | 现象 |
| 步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/LKSCN溶液,静置。 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴mol/LFe(NO3)3溶液。 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅 |
| 步骤4:向步骤1中余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀 |
②步骤3中现象a是
③用化学平衡原理解释步骤4的实验现象
更新时间:2020-04-06 09:46:56
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室模拟拉希法用氨和次氯酸钠反应制备肼(N2H4),并探究肼的性质。制备装置如下图所示。

已知:硫酸肼为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。回答下列问题:
(1)装置A试管中的试剂为_______ ,仪器a的作用是_______ 。
(2)肼的电子式为_______
(3)装置B中制备肼的化学方程式为_______ 。
(4)装置C中仪器b中导管的作用为_______ 。
(5)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是_______ 。
(6)①探究性质。取装置B中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子反应方程式_______ 。
②测定产品中肼的质量分数。称取mg装置B中溶液,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴指示剂,用cmol·L-1的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定过程中指示剂可选用_______ ,滴定终点平均消耗标准溶液VmL,产品中肼质量分数的表达式为_______ 。

已知:硫酸肼为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。回答下列问题:
(1)装置A试管中的试剂为
(2)肼的电子式为
(3)装置B中制备肼的化学方程式为
(4)装置C中仪器b中导管的作用为
(5)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是
(6)①探究性质。取装置B中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子反应方程式
②测定产品中肼的质量分数。称取mg装置B中溶液,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴指示剂,用cmol·L-1的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定过程中指示剂可选用
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】某科技小组利用NaClO, NaClO2复合吸收剂研究烟气脱硫脱硝技术.
(1)随着pH值的增大,烟气脱硫和脱硝效率均呈下降趋势,可能的原因是_________ 。
(2)若其他条件不变,改变脱硫脱硝温度对脱除效率的影响如下图所示:

随着温度的升高,脱硫和脱硝的效率先缓慢增加,后逐渐下降,分析可能原因有____ 、_____ 。
(3)在脱硫脱硝过程中存在ClO2、ClO2-和ClO3-,它们的含量可采用连续碘量滴定法测定。已知:碘量法的瘾定反应为I2+2S2O32-=2I-+S4O62-。
实验方法:取VmL试样,控制溶液pH,加入20%的碘化钾溶液4mL,暗处放置5分钟后,用0.01mol/LNa2S2O3溶液滴定,淀粉作指示剂,记录消耗Na2S2O3溶液体积。三次实验的溶液pH、反应及消耗Na2S2O3溶液的体积见下表:
注:实验②控制pH前先鼓入氮气以除去ClO2。
计算试样中ClO3-的浓度为多少mg/L(写出计算过程,用含V1、V2、V3、V的代数式表示)_____ .
(1)随着pH值的增大,烟气脱硫和脱硝效率均呈下降趋势,可能的原因是
(2)若其他条件不变,改变脱硫脱硝温度对脱除效率的影响如下图所示:

随着温度的升高,脱硫和脱硝的效率先缓慢增加,后逐渐下降,分析可能原因有
(3)在脱硫脱硝过程中存在ClO2、ClO2-和ClO3-,它们的含量可采用连续碘量滴定法测定。已知:碘量法的瘾定反应为I2+2S2O32-=2I-+S4O62-。
实验方法:取VmL试样,控制溶液pH,加入20%的碘化钾溶液4mL,暗处放置5分钟后,用0.01mol/LNa2S2O3溶液滴定,淀粉作指示剂,记录消耗Na2S2O3溶液体积。三次实验的溶液pH、反应及消耗Na2S2O3溶液的体积见下表:
| 实验 | pH | 反应 | Na2S2O3溶液体积/mL |
| ① | pH=7.0 | 2C1O2+2I-=I2+2ClO2- | V1 |
| ② | pH=4.0 | ClO2-+4I-+4H+=2I2+Cl-+2H2O | V2 |
| ③ | pH<0.1 | ClO3-+6I-+6H+=3I2+Cl-+3H2O 2ClO2+10I-+8H+=5I2+2Cl-+4H2O ClO2-+4I-+4H+=2I2+Cl-+2H2O | V3 |
注:实验②控制pH前先鼓入氮气以除去ClO2。
计算试样中ClO3-的浓度为多少mg/L(写出计算过程,用含V1、V2、V3、V的代数式表示)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】据普通高中化学课程标准要求,强酸与强碱的中和滴定是学生必做的实验。现某学生为测定NaOH溶液的浓度,用盐酸标准溶液进行滴定,实验如下:
(1)配制100 mL 0.1000 mol/L盐酸标准溶液时,所需仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要的玻璃仪器是___________ 。
(2)用___________ (填“甲”或“乙”)滴定管量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞溶液作指示剂,再用盐酸标准溶液进行滴定,本实验达到滴定终点的标志是___________ 。

(3)如图表示50 mL滴定管在滴定前后液面的位置,消耗的盐酸溶液的体中积为___________ mL,进而计算出NaOH溶液的浓度为___________ 。

(4)下列操作对测定结果有何影响? (填“偏高”“偏低”或“无影响”)
①酸式滴定管水洗后未用盐酸标准溶液润洗___________ 。
②滴定到达终点时,俯视读出滴定管读数___________ 。
③锥形瓶用水洗涤后未干燥,直接装待测液___________ 。
(1)配制100 mL 0.1000 mol/L盐酸标准溶液时,所需仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要的玻璃仪器是
(2)用

(3)如图表示50 mL滴定管在滴定前后液面的位置,消耗的盐酸溶液的体中积为

(4)下列操作对测定结果有何影响? (填“偏高”“偏低”或“无影响”)
①酸式滴定管水洗后未用盐酸标准溶液润洗
②滴定到达终点时,俯视读出滴定管读数
③锥形瓶用水洗涤后未干燥,直接装待测液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某学习小组为探究 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。
Ⅰ.配制并测定醋酸溶液中 的浓度。将
的浓度。将 的醋酸溶液进行稀释,并用
的醋酸溶液进行稀释,并用 的NaOH溶液滴定20.00mL稀释后的醋酸溶液。
的NaOH溶液滴定20.00mL稀释后的醋酸溶液。
(1)量取20.00mL醋酸溶液时,用到的仪器为_______ 。
(2)若使用酚酞做指示剂,则滴定终点的判断依据为_______ 。
(3)4次滴定实验所消耗NaOH溶液的体积如下:
计算可知,该醋酸溶液中 的浓度为
的浓度为_______ (计算结果保留4位有效数字)。
Ⅱ.探究浓度对 电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
(4)根据表中数据可以得出 是弱电解质的结论,你认为得出此结论的依据是
是弱电解质的结论,你认为得出此结论的依据是_______ ; 的电离方程式为
的电离方程式为_______ 。
(5)根据表中数据还可以得出另一个结论:随着溶液中 浓度的减小,
浓度的减小, 的电离程度将
的电离程度将_______ (填“增大”“减小”或“不变”)。
(6)由第1组实验数据计算可知,25℃时 的电离常数
的电离常数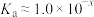 ,则
,则
_______ ;若将等体积、等物质的量浓度的 和
和 溶液混合,所得溶液显酸性,请结合数据解释其原因
溶液混合,所得溶液显酸性,请结合数据解释其原因_______ 。
 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。Ⅰ.配制并测定醋酸溶液中
 的浓度。将
的浓度。将 的醋酸溶液进行稀释,并用
的醋酸溶液进行稀释,并用 的NaOH溶液滴定20.00mL稀释后的醋酸溶液。
的NaOH溶液滴定20.00mL稀释后的醋酸溶液。(1)量取20.00mL醋酸溶液时,用到的仪器为
(2)若使用酚酞做指示剂,则滴定终点的判断依据为
(3)4次滴定实验所消耗NaOH溶液的体积如下:
| 实验次数 | 1 | 2 | 3 | 4 |
| 所消耗NaOH溶液的体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
 的浓度为
的浓度为Ⅱ.探究浓度对
 电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
电离程度的影响。用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:| 组别 | 1 | 2 | 3 | 4 | 5 |
浓度/( ) ) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
 是弱电解质的结论,你认为得出此结论的依据是
是弱电解质的结论,你认为得出此结论的依据是 的电离方程式为
的电离方程式为(5)根据表中数据还可以得出另一个结论:随着溶液中
 浓度的减小,
浓度的减小, 的电离程度将
的电离程度将(6)由第1组实验数据计算可知,25℃时
 的电离常数
的电离常数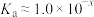 ,则
,则
 和
和 溶液混合,所得溶液显酸性,请结合数据解释其原因
溶液混合,所得溶液显酸性,请结合数据解释其原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某学生用0.10mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)___ 。
(2)判断滴定终点的现象是___ 。
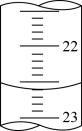
(3)如图是某次滴定时滴定管中的液面,其读数为__ mL。
(4)根据下列数据:请计算待测盐酸溶液的物质的量浓度c(HCl)=___ mol/L。
(5)若测定结果偏高,其原因可能是___ 。
A.在配制0.10mol/LNaOH标准溶液定容时,俯视容量瓶刻度线
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
(6)某同学用0.10mol/LNaOH标准溶液分别滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如图所示的两条滴定曲线:
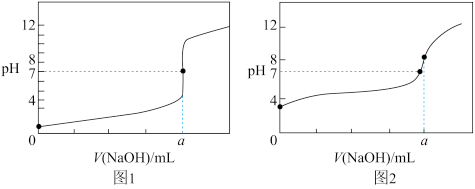
①用0.10mol/L的NaOH标准溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲线是___ (填“图1”或“图2”)。
②a=___ mL。
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)
(2)判断滴定终点的现象是
(3)如图是某次滴定时滴定管中的液面,其读数为

(4)根据下列数据:请计算待测盐酸溶液的物质的量浓度c(HCl)=
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
(5)若测定结果偏高,其原因可能是
A.在配制0.10mol/LNaOH标准溶液定容时,俯视容量瓶刻度线
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
(6)某同学用0.10mol/LNaOH标准溶液分别滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如图所示的两条滴定曲线:

①用0.10mol/L的NaOH标准溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲线是
②a=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】高锰酸钾生产过程中产生的废锰渣(主要成分为MnO2、KOH、MgO和Fe2O3)可用于制备MnSO4晶体,工艺流程如图:

该工艺条件下金属离子开始沉淀和完全沉淀的pH如表所示:
回答以下问题:
(1)提高“反应Ⅰ”速率可采取的措施是_______ (除“加热”外,任写一种),滤渣A的主要成分为_______ (填化学式)。
(2)“反应Ⅱ”中硫铁矿(FeS2)的作用为______ 。
(3)“反应Ⅲ”的离子方程式为______ 。
(4)“调pH”步骤中,应调节pH不低于_______ 。
(5)取0.1510gMnSO4固体,溶于适量水中,加硫酸酸化,用过量NaBiO3(难溶于水)将其完全氧化为MnO ,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数
,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数________ (保留三位有效数字)。

该工艺条件下金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
| 完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
(1)提高“反应Ⅰ”速率可采取的措施是
(2)“反应Ⅱ”中硫铁矿(FeS2)的作用为
(3)“反应Ⅲ”的离子方程式为
(4)“调pH”步骤中,应调节pH不低于
(5)取0.1510gMnSO4固体,溶于适量水中,加硫酸酸化,用过量NaBiO3(难溶于水)将其完全氧化为MnO
 ,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数
,过滤,洗涤,洗涤液并入滤液后,加入0.5360gNa2C2O4固体,充分反应后,用0.0320mol•L-1KMnO4溶液滴定,用去20.00mL,计算样品中MnSO4的质量分数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸_________ 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈_____ 性,原因____________________ (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为______________ 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者__________ 后者(填“>,<或=”)
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】亚磷酸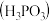 是二元酸,
是二元酸,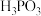 溶液存在电离平衡:
溶液存在电离平衡: 亚磷酸与足量NaOH溶液反应,生成
亚磷酸与足量NaOH溶液反应,生成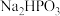 .
.

 写出亚磷酸与少量NaOH溶液反应的离子方程式
写出亚磷酸与少量NaOH溶液反应的离子方程式 _______________ ;
 某温度下,
某温度下, 的
的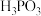 溶液pH的读数为
溶液pH的读数为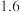 ,即此时溶液中
,即此时溶液中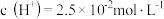 ,除
,除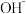 之外其他离子的浓度由小到大的顺序是
之外其他离子的浓度由小到大的顺序是 _____________ ,该温度下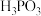 电离平衡的平衡常数
电离平衡的平衡常数
___________ 。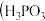 第二步电离忽略不计,结果保留两位有效数字
第二步电离忽略不计,结果保留两位有效数字
 向
向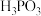 溶液中滴加NaOH溶液至中性,所得溶液中
溶液中滴加NaOH溶液至中性,所得溶液中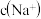
___________ 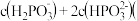 填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.
 亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式
亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 _____________ ;
 电解
电解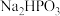 溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
 阴极的电极反应式为
阴极的电极反应式为 ________________ ;
 产品室中反应的离子方程式为
产品室中反应的离子方程式为 ______________ 。
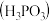 是二元酸,
是二元酸,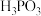 溶液存在电离平衡:
溶液存在电离平衡: 亚磷酸与足量NaOH溶液反应,生成
亚磷酸与足量NaOH溶液反应,生成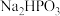 .
.
 写出亚磷酸与少量NaOH溶液反应的离子方程式
写出亚磷酸与少量NaOH溶液反应的离子方程式  某温度下,
某温度下, 的
的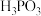 溶液pH的读数为
溶液pH的读数为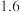 ,即此时溶液中
,即此时溶液中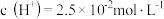 ,除
,除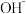 之外其他离子的浓度由小到大的顺序是
之外其他离子的浓度由小到大的顺序是 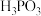 电离平衡的平衡常数
电离平衡的平衡常数
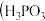 第二步电离忽略不计,结果保留两位有效数字
第二步电离忽略不计,结果保留两位有效数字
 向
向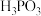 溶液中滴加NaOH溶液至中性,所得溶液中
溶液中滴加NaOH溶液至中性,所得溶液中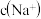
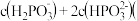 填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
. 亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式
亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式  电解
电解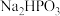 溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。 阴极的电极反应式为
阴极的电极反应式为  产品室中反应的离子方程式为
产品室中反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】用盐类水解的相关知识回答下列问题:
(1)Cu(NO3)2的水溶液呈_______ (填“酸”、“中”、“碱”)性,常温时的pH _______ 7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ ,把Al2(SO4)3溶液蒸干得到的固体产物是_______ 。
(3)在NaHCO3溶液中存在的电荷守恒式为_______ ,物料守恒式为_______ 。
(4)泡沫灭火器(药品:Al2(SO4)3溶液、NaHCO3溶液)的原理为_____ 。(用离子方程式解释)
(1)Cu(NO3)2的水溶液呈
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)在NaHCO3溶液中存在的电荷守恒式为
(4)泡沫灭火器(药品:Al2(SO4)3溶液、NaHCO3溶液)的原理为
您最近一年使用:0次
【推荐1】回答下列问题
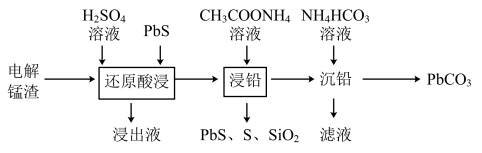
(1)电解锰渣主要含MnSO4、MnO2、PbSO4、CaSO4及少量的SiO2、Fe2(SO4)3。利用电解锰渣回收铅的工艺如下图所示:
已知: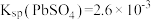 ,
,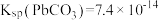 ,
,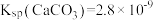 ,回答下列问题:
,回答下列问题:
①“还原酸浸”时,MnO2氧化PbS生成S的离子方程式为_____________ 。
②“浸出液”含有的盐类主要有MnSO4和少量的CaSO4、______ (填物质的化学式)。
③从平衡移动的角度看“浸铅”反应中PbSO4转化为______ (填物质的化学式)。若“浸铅”后所得溶液中c(Pb2+)=c(Ca2+)=0.1 mol/L,为实现铅与钙的分离,应控制溶液中c( )的范围是
)的范围是______ 。(当溶液中金属离子浓度小于10-5 mol/L,可以认为该离子沉淀完全。)
④“沉铅”时滤液主要的主要成分除CH3COONH4外,还有______ (填物质的化学式)。
(2)利用 PbSO4可制备PbCrO4:以PbSO4、Na2Cr2O7和NaOH为原料,通过混合后进行沉淀转化可制得PbCrO4。
已知:PbCrO4的产率(η)随pH的变化如图所示。
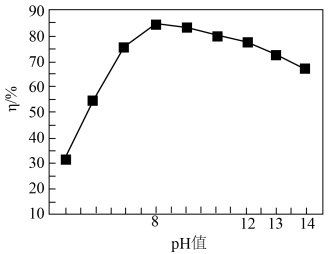
①加入NaOH的作用为______ .
②pH>8时,PbCrO4产率下降的原因为______ .
(3)25℃时,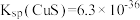 ,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。
,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。
反应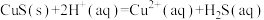 的平衡常数K=
的平衡常数K=______ (用Ksp、Ka1、Ka2表示),经计算可判断CuS难溶于稀硫酸。
(1)电解锰渣主要含MnSO4、MnO2、PbSO4、CaSO4及少量的SiO2、Fe2(SO4)3。利用电解锰渣回收铅的工艺如下图所示:

已知:
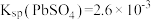 ,
,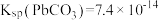 ,
,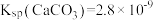 ,回答下列问题:
,回答下列问题:①“还原酸浸”时,MnO2氧化PbS生成S的离子方程式为
②“浸出液”含有的盐类主要有MnSO4和少量的CaSO4、
③从平衡移动的角度看“浸铅”反应中PbSO4转化为
 )的范围是
)的范围是④“沉铅”时滤液主要的主要成分除CH3COONH4外,还有
(2)利用 PbSO4可制备PbCrO4:以PbSO4、Na2Cr2O7和NaOH为原料,通过混合后进行沉淀转化可制得PbCrO4。
已知:PbCrO4的产率(η)随pH的变化如图所示。

①加入NaOH的作用为
②pH>8时,PbCrO4产率下降的原因为
(3)25℃时,
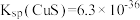 ,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。
,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。反应
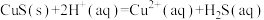 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请回答下列问题:
(1)①碳酸钠俗称_______ ,(填选项)
A.烧碱 B.苏打 C.小苏打 D.火碱
②可作为碱使用的原因是_______ (填选项)。
A.碳酸钠是碱
B.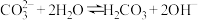
C.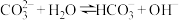
(2)为抑制水解,实验室中配制 溶液时将
溶液时将 固体溶解在浓
固体溶解在浓_______ 里面(填名称);将 溶液和
溶液和 溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是
溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是_______ (填名称,下同),无色气体是_______ 。
(3)25℃时,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的 之比为
之比为_______ 。(填选项)
A.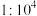 B.
B.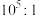 C.
C.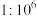
(4)25℃时, ,现将足量氯化银固体放入100mL0.2mol/L
,现将足量氯化银固体放入100mL0.2mol/L 溶液中,则溶液中氯离子的浓度为
溶液中,则溶液中氯离子的浓度为_______  (忽略溶液体积的变化)(填选项)
(忽略溶液体积的变化)(填选项)
A. B.
B. C.
C.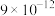
(5)某温度时, ,
,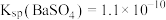 。在该温度下,向含有
。在该温度下,向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时溶液中
沉淀生成时溶液中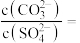
_______ (保留三位有效数字)。
(1)①碳酸钠俗称
A.烧碱 B.苏打 C.小苏打 D.火碱
②可作为碱使用的原因是
A.碳酸钠是碱
B.
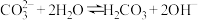
C.
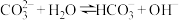
(2)为抑制水解,实验室中配制
 溶液时将
溶液时将 固体溶解在浓
固体溶解在浓 溶液和
溶液和 溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是
溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是(3)25℃时,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的
 之比为
之比为A.
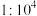 B.
B.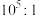 C.
C.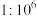
(4)25℃时,
 ,现将足量氯化银固体放入100mL0.2mol/L
,现将足量氯化银固体放入100mL0.2mol/L 溶液中,则溶液中氯离子的浓度为
溶液中,则溶液中氯离子的浓度为 (忽略溶液体积的变化)(填选项)
(忽略溶液体积的变化)(填选项)A.
 B.
B. C.
C.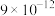
(5)某温度时,
 ,
,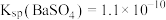 。在该温度下,向含有
。在该温度下,向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时溶液中
沉淀生成时溶液中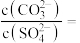
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】对废旧干电池拆解后的碳包滤渣(含 、C、
、C、 等)再加工,既可制取高纯
等)再加工,既可制取高纯 又可消除废弃物对环境的污染。实验流程如下:
又可消除废弃物对环境的污染。实验流程如下:
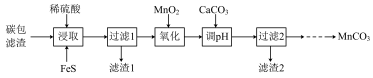
已知: ,MnS都是不溶于水的沉淀。
,MnS都是不溶于水的沉淀。
(1)“浸取”时,为了提高碳包滤渣的浸取率,除了控制温度70℃左右外,还可以采取的措施有___________ (写出一种即可),浸取后生成 和
和 ,则浸取过程中发生的主要反应的化学方程式为
,则浸取过程中发生的主要反应的化学方程式为___________ 。
(2)实验流程中,“氧化”步骤的目的是___________ ;滤渣2的主要成分为___________ (填化学式)。
(3)为了提高 的纯度,滤液
的纯度,滤液 溶液与
溶液与 溶液的混合方式为
溶液的混合方式为___________ 。
(4) 产率与“浸取”时
产率与“浸取”时 的投料比关系如图所示,FeS用量超过最佳值时,
的投料比关系如图所示,FeS用量超过最佳值时, 产率反而变小的原因是
产率反而变小的原因是___________ 。

 、C、
、C、 等)再加工,既可制取高纯
等)再加工,既可制取高纯 又可消除废弃物对环境的污染。实验流程如下:
又可消除废弃物对环境的污染。实验流程如下:
已知:
 ,MnS都是不溶于水的沉淀。
,MnS都是不溶于水的沉淀。(1)“浸取”时,为了提高碳包滤渣的浸取率,除了控制温度70℃左右外,还可以采取的措施有
 和
和 ,则浸取过程中发生的主要反应的化学方程式为
,则浸取过程中发生的主要反应的化学方程式为(2)实验流程中,“氧化”步骤的目的是
(3)为了提高
 的纯度,滤液
的纯度,滤液 溶液与
溶液与 溶液的混合方式为
溶液的混合方式为(4)
 产率与“浸取”时
产率与“浸取”时 的投料比关系如图所示,FeS用量超过最佳值时,
的投料比关系如图所示,FeS用量超过最佳值时, 产率反而变小的原因是
产率反而变小的原因是
您最近一年使用:0次



