名校
解题方法
1 . 对甲基苯胺可用对硝基甲苯作原料在一定条件制得。主要反应及装置如下:

主要反应物和产物的物理性质见下表:
实验步骤如下:
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如图,a处缺少的装置是_______ (填仪器名称),实验步骤③和④的分液操作中使用到下列仪器中的_______ (填标号)。
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH=7~8的目的之一是使Fe3+转化为氢氧化铁沉淀,另一个目的是_______ 。
(3)步骤③中液体M是分液时的_______ 层(填“上”或“下”)液体,加入盐酸的作用是_______ 。
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有_______ 。
(5)步骤⑤中,以下洗涤剂中最合适的是_______ (填标号)。
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是_______ %。(计算结果保留一位小数)

主要反应物和产物的物理性质见下表:
| 化合物 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
| 对硝基甲苯 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
| 对甲基苯胺 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
| 对甲基苯胺盐酸盐 | 易溶于水,不溶于乙醇、苯 | 243~245 | -- | -- |
| 苯 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如图,a处缺少的装置是
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH=7~8的目的之一是使Fe3+转化为氢氧化铁沉淀,另一个目的是
(3)步骤③中液体M是分液时的
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有
(5)步骤⑤中,以下洗涤剂中最合适的是
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是
您最近半年使用:0次
2022-10-31更新
|
1160次组卷
|
4卷引用:四川省绵阳中学2021-2022学年高三上学期高考化学仿真试卷(一)
名校
2 . 实验室常用乙醇与浓硫酸的混合液加热的方法制取乙烯。反应中常因温度而发生副反应。请选用下列装置(装置可以使用多次)完成相关实验并回答有关问题:
(1)制备乙烯时,加热时要使溶液的温度迅速上升到170℃以上,因为在140℃左右易生成乙醚,该有机物的结构简式为_______ ;生成乙烯的化学方程式为_______ 。
(2)乙醇与浓硫酸加热制取乙烯时,乙烯气体中常混有SO2和CO2,为验证有副产物SO2和CO2气体存在,上述仪器的连接顺序为a→_______ 。
(3)某同学设计制备1,2-二溴乙烷的装置连接顺序为A→E→C→D,已知1,2-二溴乙烷的主要物理性质有:难溶于水、熔点9℃、沸点132℃、密度2.2g·cm-3。
①E装置的作用_______ ;
②分离D装置中1,2-二溴乙烷的操作方法是加入NaHSO3溶液,充分反应后进行_______ 操作。
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是_______ 。

(1)制备乙烯时,加热时要使溶液的温度迅速上升到170℃以上,因为在140℃左右易生成乙醚,该有机物的结构简式为
(2)乙醇与浓硫酸加热制取乙烯时,乙烯气体中常混有SO2和CO2,为验证有副产物SO2和CO2气体存在,上述仪器的连接顺序为a→
(3)某同学设计制备1,2-二溴乙烷的装置连接顺序为A→E→C→D,已知1,2-二溴乙烷的主要物理性质有:难溶于水、熔点9℃、沸点132℃、密度2.2g·cm-3。
①E装置的作用
②分离D装置中1,2-二溴乙烷的操作方法是加入NaHSO3溶液,充分反应后进行
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是
您最近半年使用:0次
名校
解题方法
3 . 乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应装置示意图如图:
反应为: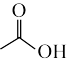 +
+
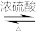
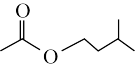 +H2O
+H2O
相关物质性质如表:
实验步骤:在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140-143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)装置B的名称是____ ;主要作用是:____ 。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时____ (填序号)。
(3)在洗涤操作中,第一次水洗的主要目的是____ 。
(4)实验中加入少量无水硫酸镁的目的是____ 。
(5)本实验的产率是____ 。
(6)在进行蒸馏操作时,若从130℃开始收集馏分,产率会偏____ (填“高”或“低”)。

反应为:
 +
+
 +H2O
+H2O相关物质性质如表:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
(1)装置B的名称是
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时
| A.立即补加 | B.冷却后补加 | C.不需补加 | D.重新配料 |
(4)实验中加入少量无水硫酸镁的目的是
(5)本实验的产率是
(6)在进行蒸馏操作时,若从130℃开始收集馏分,产率会偏
您最近半年使用:0次
名校
解题方法
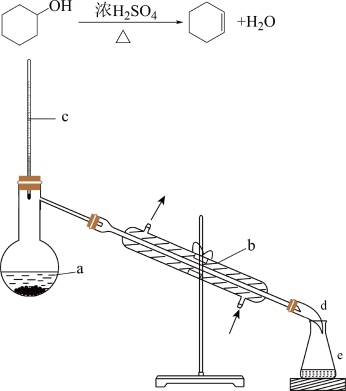
4 . 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
可能用到的有关数据如表:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是_______ 。
(2)加入碎瓷片的作用是_______ 。
(3)本实验中最容易产生的副产物的结构简式为_______ 。
(4)分液漏斗在使用前须清洗干净并_______ ;在本实验分离过程中,产物应该从分液漏斗的_______ (填“上口倒出”或“下口放出”)。
(5)本实验所得到的环己烯产率是_______(填正确答案标号)。

可能用到的有关数据如表:
| 相对分子质量 | 密度/(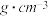 ) ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是
(2)加入碎瓷片的作用是
(3)本实验中最容易产生的副产物的结构简式为
(4)分液漏斗在使用前须清洗干净并
(5)本实验所得到的环己烯产率是_______(填正确答案标号)。
| A.41% | B.50% | C.61% | D.70% |
您最近半年使用:0次
解题方法
5 . 下图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置(省去了加热装置),回答下列问题:
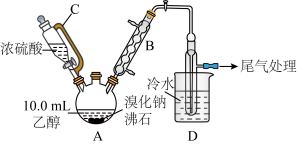
已知:浓硫酸与溴化钠共热时发生反应:
(1)仪器A、C的名称分别为_______ 、_______ ;B的作用为_______ 。
(2)装置A中生成溴乙烷的化学方程式为_______ 。
(3)若选用的硫酸浓度过大,D中得到的产品则会因混入少量溴而呈棕黄色,生成这一副产物的原因为_______ (用化学方程式表示);为纯化产物,最好选择下列的_______ 溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.碘化钠 D.亚硫酸钠
(4)若实验中使用了10g乙醇、20.6g溴化钠,且浓硫酸足量,经过分离、提纯、干燥后,最终得到10.9g溴乙烷,则本实验中溴乙烷的产率为_______ (保留3位有效数字)。
(5)检验溴乙烷中溴元素的方法为:取样,_______ ,若产生淡黄色沉淀,则该物质中存在溴元素。

已知:浓硫酸与溴化钠共热时发生反应:

(1)仪器A、C的名称分别为
(2)装置A中生成溴乙烷的化学方程式为
(3)若选用的硫酸浓度过大,D中得到的产品则会因混入少量溴而呈棕黄色,生成这一副产物的原因为
A.四氯化碳 B.硫酸钠 C.碘化钠 D.亚硫酸钠
(4)若实验中使用了10g乙醇、20.6g溴化钠,且浓硫酸足量,经过分离、提纯、干燥后,最终得到10.9g溴乙烷,则本实验中溴乙烷的产率为
(5)检验溴乙烷中溴元素的方法为:取样,
您最近半年使用:0次
2022-10-25更新
|
328次组卷
|
2卷引用:内蒙古自治区鄂尔多斯市达拉特旗第一中学2021-2022学年高二下学期期末考试化学试题
解题方法
6 . 已知数据:
实验室制取乙酸乙酯的主要步骤如下:①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;④分离出乙酸乙酯层、洗涤和干燥。

请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式_______ 。
(2)上述实验中饱和碳酸钠溶液的作用是_______(填字母代号)。
(3)反应中加入浓硫酸的作用是_______ 、_______ 。
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙醇 | -117.3 | 78.5 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |

请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式
(2)上述实验中饱和碳酸钠溶液的作用是_______(填字母代号)。
| A.反应掉乙酸和乙醇 |
| B.反应掉乙酸并吸收部分乙醇 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出 |
| D.加速酯的生成,提高其产率 |
您最近半年使用:0次
解题方法
7 . 二氯异氰尿酸钠(C3N3O3Cl2Na),是一种用途广泛的广谱、高效、低毒的消毒杀菌剂。它常温下为白色固体,难溶于冷水。实验室利用高浓度的NaClO溶液和氰尿酸(C3H3N3O3)溶液在10℃下反应制备二氯异氰尿酸钠,实验装置如图所示。
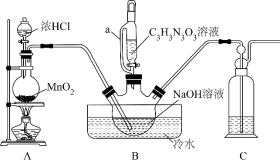
已知:①Cl2+6NaOH=NaClO3+5NaCl+3H2O
②2NaClO+C3H3N3O3=NaC3N3O3Cl2+NaOH+H2O
③二氯异氰尿酸钠难溶于冷水和有机溶剂,受热易分解出剧毒的烟气。
回答下列问题:
(1)仪器a的名称为_______ ,装置C的作用是_______ 。
(2)装置A中发生的离子反应方程式为_______ 。
(3)装置B冰水浴的作用是_______ ,三颈烧瓶中的多孔球泡的作用是_______ 。若在三颈烧瓶液面上出现黄绿色气体时,由仪器a加入C3H3N3O3,反应过程中仍需不断通入Cl2,原因是_______ 。
(4)上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是_______ 。
(5)反应结束后,装置B中的浊液经过滤、_______ 、干燥得粗产品二氯异氰尿酸钠。

已知:①Cl2+6NaOH=NaClO3+5NaCl+3H2O
②2NaClO+C3H3N3O3=NaC3N3O3Cl2+NaOH+H2O
③二氯异氰尿酸钠难溶于冷水和有机溶剂,受热易分解出剧毒的烟气。
回答下列问题:
(1)仪器a的名称为
(2)装置A中发生的离子反应方程式为
(3)装置B冰水浴的作用是
(4)上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是
(5)反应结束后,装置B中的浊液经过滤、
您最近半年使用:0次
名校
8 . 乙烯是重要化工原料。结合以下路线回答下列问题

(1)反应①的化学方程式是____ ,B的官能团名称是____ ,③的反应类型是 _____ 。
(2)F是一种高分子物质,可用于制作食品塑料袋等,F的结构简式是_______ 。
(3)E的分子式是C2H4O2能使紫色石蕊试液变红;G是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取G,装置如图所示。
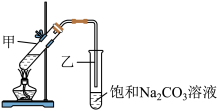
i.饱和Na2CO3溶液不可以用NaOH溶液代替,原因是_______ (用化学方程式解释),
ii.分离出试管乙中油状液体用到的主要仪器是_______
iii.如果将 4. 6 g D 和 3.0 g E 在催化剂条件下发生上述反应 ,充分反应后,实际得到2.64 g G,则该实验G的产率为_______ (已知:实际产率=  )。
)。

(1)反应①的化学方程式是
(2)F是一种高分子物质,可用于制作食品塑料袋等,F的结构简式是
(3)E的分子式是C2H4O2能使紫色石蕊试液变红;G是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取G,装置如图所示。

i.饱和Na2CO3溶液不可以用NaOH溶液代替,原因是
ii.分离出试管乙中油状液体用到的主要仪器是
iii.如果将 4. 6 g D 和 3.0 g E 在催化剂条件下发生上述反应 ,充分反应后,实际得到2.64 g G,则该实验G的产率为
 )。
)。
您最近半年使用:0次
解题方法
9 . 某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。请回答下列问题:

(1)A装置的名称_______ ,水从_______ (填“a”或“b”)处进入。
(2)已知下列数据:
又知温度高于140℃时发生副反应:2CH3CH2OH CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
①该副反应属于_______ 反应(填字母)。
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是_______ (填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______。
(4)欲分离出乙酸乙酯,应使用的分离方法是_______ (填操作方法名称,下同),所用到的仪器为_______ ,进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用_______ 的方法。
(5)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是_______ 。

(1)A装置的名称
(2)已知下列数据:
| 乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
| 熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | ﹣ |
| 沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O①该副反应属于
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______。
| A.中和乙酸和乙醇 |
| B.中和乙酸并吸收部分乙醇 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出 |
| D.加速酯的生成,提高其产率 |
(5)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是
您最近半年使用:0次
解题方法
10 . 利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
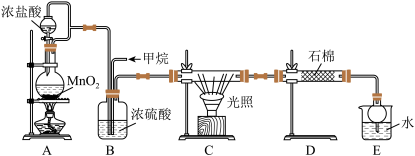
(1)A中制取Cl2的反应的化学方程式是____ 。
(2)B装置的作用:①____ ;②____ ;③____ 。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是____ 。
(4)E装置的作用是____ (填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是____ 。
(6)将1molCH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是____ 。
(7)E中发生反应的化学方程式是____ 。
(8)C中发生反应的化学方程式是____ 。

(1)A中制取Cl2的反应的化学方程式是
(2)B装置的作用:①
(3)D装置中的石棉上吸附着潮湿的KI,其作用是
(4)E装置的作用是
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是
(6)将1molCH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是
(7)E中发生反应的化学方程式是
(8)C中发生反应的化学方程式是
您最近半年使用:0次



