1 . 乙酸乙酯是一种重要的有机溶剂,在工业上有广泛用途。某兴趣小组同学欲制备乙酸乙酯并对所得产物进行探究。
I.乙酸乙酯的制备
实验装置如下图所示:
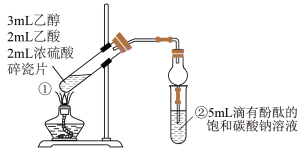
(1)试管①中反应的化学方程式为_______ 。
II.产物的探究
反应结束后在试管②中看到分层现象,上层为无色透明的油状液体。取下试管②进行振荡,下层溶液红色褪去。甲同学认为下层溶液褪色是蒸出的乙酸中和了碳酸钠,乙同学通过查阅资料对甲同学的推测产生质疑。
资料:酚酞是一种白色晶状粉末,不溶于水,可溶于乙醇。酚酞试剂是酚酞的乙醇溶液。
(2)乙同学的推测是:_______ 。
两位同学针对各自的推测又进行了如下实验。
实验1:
甲同学用pH计测得饱和碳酸钠溶液(浓度约为2mol/L)的pH为12.23;
按照上述方法进行乙酸乙酯的制取实验,实验结束后,取振荡后的试管②中下层无色液体,分成三份,分别完成以下实验:
(3)b中现象为_______ ,实验1的结论_______ 。
实验2:
(4)e中的实验现象为_______ 。
甲乙两位同学通过对乙酸乙酯收集装置中产生的现象进一步实验和分析,最终确认了酚酞褪色的原因。
III.拓展延伸
在以上实验过程中,丙同学还有新的发现,他查阅到以下资料:
资料:室温下,当酚酞试剂滴入pH>13的无色溶液时,溶液先变红,静置后褪色。
(5)据此资料,丙同学想到了一种区分1mol/L碳酸钠溶液和1mol/L氢氧化钠溶液的方法,这种方法是_______ 。
I.乙酸乙酯的制备
实验装置如下图所示:

(1)试管①中反应的化学方程式为
II.产物的探究
反应结束后在试管②中看到分层现象,上层为无色透明的油状液体。取下试管②进行振荡,下层溶液红色褪去。甲同学认为下层溶液褪色是蒸出的乙酸中和了碳酸钠,乙同学通过查阅资料对甲同学的推测产生质疑。
资料:酚酞是一种白色晶状粉末,不溶于水,可溶于乙醇。酚酞试剂是酚酞的乙醇溶液。
(2)乙同学的推测是:
两位同学针对各自的推测又进行了如下实验。
实验1:
甲同学用pH计测得饱和碳酸钠溶液(浓度约为2mol/L)的pH为12.23;
按照上述方法进行乙酸乙酯的制取实验,实验结束后,取振荡后的试管②中下层无色液体,分成三份,分别完成以下实验:
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| a | 滴加几滴酚酞试剂 | 溶液变红 | ______ |
| b | 滴入乙酸溶液 | _______ | |
| c | 用pH计测溶液pH | pH为12.21 |
实验2:
| 序号 | 操作 | 现象 |
| d | 试管②中分离出的上层液体,加入饱和碳酸钠溶液,振荡 | 溶液变成浅红色,静置分层后红色消失 |
| e | 取5mL饱和碳酸钠溶液,滴入几滴酚酞试剂,再加入与试管②中上层液体体积相等的纯净的乙酸乙酯,振荡 |
甲乙两位同学通过对乙酸乙酯收集装置中产生的现象进一步实验和分析,最终确认了酚酞褪色的原因。
III.拓展延伸
在以上实验过程中,丙同学还有新的发现,他查阅到以下资料:
资料:室温下,当酚酞试剂滴入pH>13的无色溶液时,溶液先变红,静置后褪色。
(5)据此资料,丙同学想到了一种区分1mol/L碳酸钠溶液和1mol/L氢氧化钠溶液的方法,这种方法是
您最近一年使用:0次
2023-01-11更新
|
371次组卷
|
3卷引用:北京市通州区2022-2023学年高三上学期期末考试化学试题
名校
解题方法
2 . 用如下装置制备并收集乙烯,下列说法正确的是
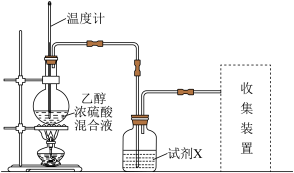

| A.为防止暴沸,烧瓶中应放入几片碎瓷片 |
| B.为控制反应温度,温度计的量程为0~150℃ |
C.为除去杂质 ,试剂X可选择酸性 ,试剂X可选择酸性 溶液 溶液 |
| D.可用排气法或排水法收集乙烯 |
您最近一年使用:0次
2023-01-11更新
|
332次组卷
|
3卷引用:上海市浦东新区2022-2023学年高三上学期期末练习化学试题
名校
解题方法
3 . 如下图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓 并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
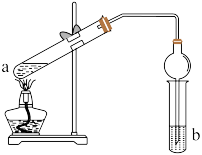
(1)写出a试管中的主要化学反应的方程式_______ ;
(2)加入浓 的目的是
的目的是_______ ;
(3)在实验中球形干燥管除起冷凝作用外,另一个重要作用是_______ ,其原因是_______ 。
(4)饱和 溶液的作用是
溶液的作用是_______ 。
 并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
(1)写出a试管中的主要化学反应的方程式
(2)加入浓
 的目的是
的目的是(3)在实验中球形干燥管除起冷凝作用外,另一个重要作用是
(4)饱和
 溶液的作用是
溶液的作用是
您最近一年使用:0次
4 . 实验室制乙烯原理为:CH3CH2OH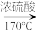 CH2=CH2↑+H2O,(可能的副反应为CH3CH2OH+6H2SO4(浓)
CH2=CH2↑+H2O,(可能的副反应为CH3CH2OH+6H2SO4(浓) 2CO2↑+6SO2↑+9H2O)装置如图所示。
2CO2↑+6SO2↑+9H2O)装置如图所示。
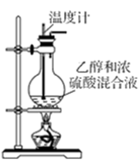
(1)盛装乙醇和浓硫酸混合溶液的玻璃仪器名称是_____ ,混合液中加入沸石的目的是_____ ,乙醇与浓硫酸应先在烧杯中混合好后再注入仪器,混合浓硫酸与乙醇的操作方法是_____ 。
(2)将生成的乙烯通入溴水之中,可以观察到的现象是溶液逐渐褪色、_____ ,发生的化学反应方程式是______ ,其反应类型是______ 。
(3)同学甲认为(2)中溶液褪色还可能是物质_____ (填写化学式)引起的,检验该物质的试剂为_____ (填序号)
A.BaCl2溶液 B.NaOH溶液 C.品红溶液
(4)已知乙烯在溴水中与溴反应的机理如下:
①溴分子在水分子作用下异裂为Br+和Br-;
②乙烯先与Br+作用生成中间体溴鎓离子( ),进而结合Br-完成反应。根据该反应机理,乙烯与溴水反应除上述产物外,还可能生成的其它产物的结构简式
),进而结合Br-完成反应。根据该反应机理,乙烯与溴水反应除上述产物外,还可能生成的其它产物的结构简式______ (一种即可)。
 CH2=CH2↑+H2O,(可能的副反应为CH3CH2OH+6H2SO4(浓)
CH2=CH2↑+H2O,(可能的副反应为CH3CH2OH+6H2SO4(浓) 2CO2↑+6SO2↑+9H2O)装置如图所示。
2CO2↑+6SO2↑+9H2O)装置如图所示。
(1)盛装乙醇和浓硫酸混合溶液的玻璃仪器名称是
(2)将生成的乙烯通入溴水之中,可以观察到的现象是溶液逐渐褪色、
(3)同学甲认为(2)中溶液褪色还可能是物质
A.BaCl2溶液 B.NaOH溶液 C.品红溶液
(4)已知乙烯在溴水中与溴反应的机理如下:
①溴分子在水分子作用下异裂为Br+和Br-;
②乙烯先与Br+作用生成中间体溴鎓离子(
 ),进而结合Br-完成反应。根据该反应机理,乙烯与溴水反应除上述产物外,还可能生成的其它产物的结构简式
),进而结合Br-完成反应。根据该反应机理,乙烯与溴水反应除上述产物外,还可能生成的其它产物的结构简式
您最近一年使用:0次
名校
解题方法
5 . 正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下: 
反应物和产物的相关数据如下:
合成反应:
①将一定量的浓硫酸和14.8g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有一定量水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用蒸馏水、NaOH溶液和蒸馏水洗涤,分液后再加入一定质量的无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得正丁醚6.5g。

请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为_______ 。
(2)加热A前,需先从_______ (填“a”或“b”)口向B中通入水。
(3)分液漏斗在使用前须清洗干净并_______
(4)步骤④中加入NaOH溶液洗涤的目的为_______ 。
(5)步骤⑤中,加热蒸馏时应收集_______(填选项字母)左右的馏分。
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A,下层液体的主要成分为_______ ,反应完成的现象是_______ 。
(7)该实验的产率是_______ 。

反应物和产物的相关数据如下:
| 相对分子质量 | 沸点/℃ | 密度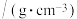 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将一定量的浓硫酸和14.8g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有一定量水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用蒸馏水、NaOH溶液和蒸馏水洗涤,分液后再加入一定质量的无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得正丁醚6.5g。

请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为
(2)加热A前,需先从
(3)分液漏斗在使用前须清洗干净并
(4)步骤④中加入NaOH溶液洗涤的目的为
(5)步骤⑤中,加热蒸馏时应收集_______(填选项字母)左右的馏分。
| A.100℃ | B.117℃ | C.135℃ | D.142℃ |
(7)该实验的产率是
您最近一年使用:0次
2023-01-10更新
|
398次组卷
|
2卷引用:黑龙江省哈尔滨市第一二二中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
6 . 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题:
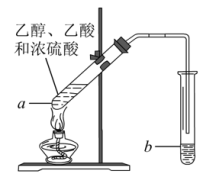
(1)乙醇分子中官能团的名称是_______ 。
(2)试管a中加入几块碎瓷片的目的是_______ 。
(3)试管a中发生反应的化学方程式为_______ 。
(4)反应开始前,试管b中盛放的是_______ 溶液,其作用为_______ 、_______ 、_______ 。
(5)可用_______ 的方法把制得的乙酸乙酯分离出来。

(1)乙醇分子中官能团的名称是
(2)试管a中加入几块碎瓷片的目的是
(3)试管a中发生反应的化学方程式为
(4)反应开始前,试管b中盛放的是
(5)可用
您最近一年使用:0次
名校
解题方法
7 . 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下。
反应: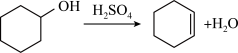
装置: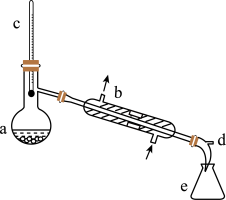
本实验可能用到的有关数据:
合成反应:
在 a 中加入 20g 环己醇和 2 小片碎瓷片,冷却搅动下慢慢加入 1 mL 浓硫酸。b 中通入冷却水后,开始缓慢加热 a,控制馏出物的温度。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量 5% Na2CO3溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯 10g。
回答下列问题:
(1)装置 a、b 的名称分别是_______ 、_______ 。
(2)a 装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 _______(填选项)。
(3)本实验合成反应中控制馏出物的温度不宜超过_______ (填选项)。
(4)本实验中最容易产生的副产物的结构简式为_______ 。
(5)本实验分离提纯过程中,产物应该从分液漏斗的_______ (填“上口倒出”或“下口放出”)。
(6)分离提纯过程中加入无水氯化钙的目的是_______ 。
(7)本实验所得到的环己烯的产率百分数是_______ 。(保留两位有效数字)
反应:
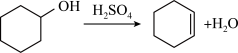
装置:

本实验可能用到的有关数据:
| 相对分子质量 | 密度/(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在 a 中加入 20g 环己醇和 2 小片碎瓷片,冷却搅动下慢慢加入 1 mL 浓硫酸。b 中通入冷却水后,开始缓慢加热 a,控制馏出物的温度。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量 5% Na2CO3溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯 10g。
回答下列问题:
(1)装置 a、b 的名称分别是
(2)a 装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 _______(填选项)。
| A.立即补加 | B.不需补加 | C.冷却后补加 | D.重新配料 |
| A.100℃ | B.90℃ | C.80℃ | D.50℃ |
(5)本实验分离提纯过程中,产物应该从分液漏斗的
(6)分离提纯过程中加入无水氯化钙的目的是
(7)本实验所得到的环己烯的产率百分数是
您最近一年使用:0次
2023-01-09更新
|
767次组卷
|
5卷引用:广东实验中学、广州广雅中学、广州市执信中学、广州市第二中学、广州市第六中学五校2022-2023学年高二上学期期末联考化学试题
广东实验中学、广州广雅中学、广州市执信中学、广州市第二中学、广州市第六中学五校2022-2023学年高二上学期期末联考化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(实验探究题)(已下线)专题07 醇和酚(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)山东省济南市莱芜第一中学2022-2023学年高二下学期第二次阶段性检测化学试题吉林省长春市第十七中学2022-2023学年高二下学期7月期末考试化学试题
名校
解题方法
8 . 如图是用实验室制得的乙烯( CH3CH2OH CH2=CH2↑+H2O)与溴水作用制取 1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取 1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
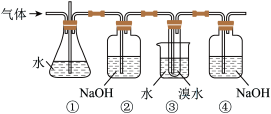
 CH2=CH2↑+H2O)与溴水作用制取 1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取 1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
| A.装置①和装置③中都盛有水,其作用相同 |
| B.装置②和装置④中都盛有 NaOH 溶液,其吸收的杂质相同 |
| C.制备乙烯和生成 1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
| D.若产物中有少量未反应的 Br2, 可以用碘化钠洗涤除去 |
您最近一年使用:0次
2023-01-09更新
|
630次组卷
|
3卷引用:广东实验中学、广州广雅中学、广州市执信中学、广州市第二中学、广州市第六中学五校2022-2023学年高二上学期期末联考化学试题
广东实验中学、广州广雅中学、广州市执信中学、广州市第二中学、广州市第六中学五校2022-2023学年高二上学期期末联考化学试题江西省丰城中学2022-2023学年高二下学期入学考试化学试题(已下线)专题06 卤代烃(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)
解题方法
9 . 环己烯是重要的化工原料。其实验室制备流程如下:
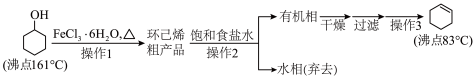
操作1的实验装置如图所示(加热和夹持装置已略去)。
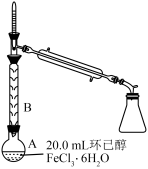
回答下列问题:
(1)烧瓶A中进行反应的化学方程式为_______ ,浓硫酸也可作该反应的催化剂。相比浓硫酸,选择 作催化剂的优点是
作催化剂的优点是_______ (写出一条即可)。
(2)已知环己烯的密度为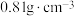 ,进行操作2前加饱和食盐水而不加蒸馏水的原因是
,进行操作2前加饱和食盐水而不加蒸馏水的原因是_______ 。
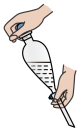
(3)操作2为分液,下列关于分液漏斗的使用,叙述正确的是_______。
(4)操作3(蒸馏)的步骤:安装蒸馏装置,加入待蒸馏的物质和沸石,通冷凝水,加热,弃去前馏分,收集83℃馏分的质量为7.6g,则环己烯的产率为_______ %(已知环己醇的密度为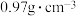 ,计算结果保留1位小数)。
,计算结果保留1位小数)。

操作1的实验装置如图所示(加热和夹持装置已略去)。

回答下列问题:
(1)烧瓶A中进行反应的化学方程式为
 作催化剂的优点是
作催化剂的优点是(2)已知环己烯的密度为
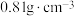 ,进行操作2前加饱和食盐水而不加蒸馏水的原因是
,进行操作2前加饱和食盐水而不加蒸馏水的原因是(3)操作2为分液,下列关于分液漏斗的使用,叙述正确的是_______。

| A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞处不漏水即可使用 |
| B.分液时环己烯应从上口倒出 |
| C.振荡萃取操作应如图所示,并打开玻璃塞不断放气 |
| D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔 |
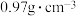 ,计算结果保留1位小数)。
,计算结果保留1位小数)。
您最近一年使用:0次
名校
解题方法
10 . 某兴趣小组利用下图装置,制备少量的溴苯并探究其反应类型。

请回答下列问题:
(1)先向分液漏斗中加入苯和液溴,再将苯和液溴的混合液缓慢滴入反应器A中(A下端活塞处于关闭状态),则A中反应的化学方程式为_______ 。
(2)通过以下步骤可获取较纯净的溴苯:
①反应结束后打开A下端的活塞,让反应液流入B中;
②充分反应后,将B中液体转移至分液漏斗中,振荡、静置并分液;
③向有机层中加入蒸馏水洗涤,振荡、静置并分液;
④向有机层中加入无水 粉末干燥并过滤;
粉末干燥并过滤;
⑤对滤液进行操作1获取较纯净的溴苯。
B中发生的氧化还原反应的离子方程式为_______ ,步骤⑤中操作1的名称为_______ 。
(3)若要证明苯和液溴的反应为取代反应,则C中盛放 的作用是
的作用是_______ ,请设计后续实验方案证明苯和液溴的反应为取代反应_______ 。

请回答下列问题:
(1)先向分液漏斗中加入苯和液溴,再将苯和液溴的混合液缓慢滴入反应器A中(A下端活塞处于关闭状态),则A中反应的化学方程式为
(2)通过以下步骤可获取较纯净的溴苯:
①反应结束后打开A下端的活塞,让反应液流入B中;
②充分反应后,将B中液体转移至分液漏斗中,振荡、静置并分液;
③向有机层中加入蒸馏水洗涤,振荡、静置并分液;
④向有机层中加入无水
 粉末干燥并过滤;
粉末干燥并过滤;⑤对滤液进行操作1获取较纯净的溴苯。
B中发生的氧化还原反应的离子方程式为
(3)若要证明苯和液溴的反应为取代反应,则C中盛放
 的作用是
的作用是
您最近一年使用:0次
2023-01-07更新
|
359次组卷
|
2卷引用:河南省郑州市2021-2022学年高一下学期期末考试化学试题



