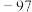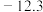解题方法
1 . 实验室制备乙酸丁酯,反应温度要控制在115℃~125℃之间,其他有关数据如下表:
关于实验室制备乙酸丁酯的叙述正确的是
| 物质 | 乙酸 | 1−丁醇 | 乙酸丁酯 | 98%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
| A.不能边反应边蒸出乙酸丁酯的原因:乙酸丁酯的沸点高 |
| B.不用水浴加热是因为:乙酸丁酯的沸点高于100℃ |
| C.从反应后混合物分离出粗品的方法:用NaOH溶液洗涤后分液 |
| D.由粗品制精品需要进行的一步操作:加吸水剂分液 |
您最近一年使用:0次
解题方法
2 . 用下列装置依次进行乙烯的制取、除杂、性质检验和气体收集,其中不能 实现相应实验目的的是
 | 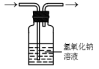 | 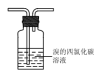 |  |
| A.制取 | B.除杂 | C.性质 | D.收集 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 采用如图装置制取一定量的饱和氯水,并进行氯水的性质实验。
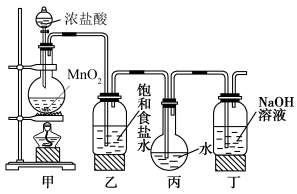
(1)在装入药品前应进行的操作______________ 。
(2)写出丁装置中发生反应的离子方程式:________ 。
(3)用制得的饱和氯水分别进行下列实验:
①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的离子是___________ ;
②滴到蓝色石蕊试纸上的现象:_______________ 。
(4)久置的氯水漂白效果明显不足或消失,原因用化学方程式表示:_________________ 。
(5)将制得的饱和氯水慢慢滴入含有酚酞的 稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种
稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种 简要文字说明
简要文字说明 :
:

______________________ ;

______________________ 。

(1)在装入药品前应进行的操作
(2)写出丁装置中发生反应的离子方程式:
(3)用制得的饱和氯水分别进行下列实验:
①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的离子是
②滴到蓝色石蕊试纸上的现象:
(4)久置的氯水漂白效果明显不足或消失,原因用化学方程式表示:
(5)将制得的饱和氯水慢慢滴入含有酚酞的
 稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种
稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种 简要文字说明
简要文字说明 :
:

您最近一年使用:0次
22-23高二上·上海浦东新·期末
名校
解题方法
4 . I.A是相对分子质量为28的烃,它的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成乙酸乙酯(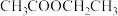 ),合成路线如图所示。
),合成路线如图所示。
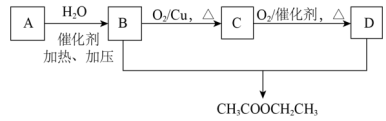
回答下列问题:
(1)写出A的结构简式_______ 。
II.实验室用如图所示的装置制取乙酸乙酯。
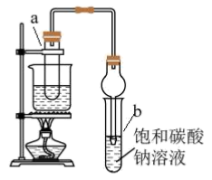
(2)在实验中球形干燥管除起冷凝作用外,另一个重要作用是_______ 。
(3)试管b中观察到的现象是_______ 。试管a中生成乙酸乙酯的化学方程式为_______ 。b使用饱和 溶液的作用是
溶液的作用是_______ 、_______ 、_______ 。
(4)工业上用A和 在一定条件下直接反应制得乙酸乙酯。
在一定条件下直接反应制得乙酸乙酯。
①反应类型是_______ 反应(填“加成或取代”)。
②与实验室制法相比,工业制法的优点是_______ 。
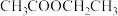 ),合成路线如图所示。
),合成路线如图所示。
回答下列问题:
(1)写出A的结构简式
II.实验室用如图所示的装置制取乙酸乙酯。

(2)在实验中球形干燥管除起冷凝作用外,另一个重要作用是
(3)试管b中观察到的现象是
 溶液的作用是
溶液的作用是(4)工业上用A和
 在一定条件下直接反应制得乙酸乙酯。
在一定条件下直接反应制得乙酸乙酯。①反应类型是
②与实验室制法相比,工业制法的优点是
您最近一年使用:0次
名校
解题方法
5 . 完成下列问题
(1)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置都可以选用。关于这两套装置的说法正确的是_______ 。(选填编号)
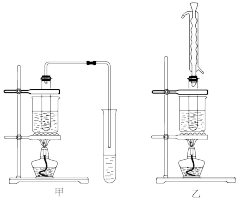
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(2)用乙装置实验时,提纯乙中乙酸乙酯的流程如下:
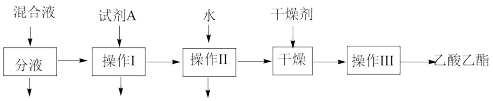
以上流程中试剂A的化学式是_______ ;操作Ⅱ的名称是_______ ;操作Ⅲ一般适用于分离_______ 混合物。
(1)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置都可以选用。关于这两套装置的说法正确的是

| 物质 | 沸点(℃) |
| 乙醇 | 78.5 |
| 乙酸 | 117.9 |
| 乙酸乙酯 | 77 |
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(2)用乙装置实验时,提纯乙中乙酸乙酯的流程如下:

以上流程中试剂A的化学式是
您最近一年使用:0次
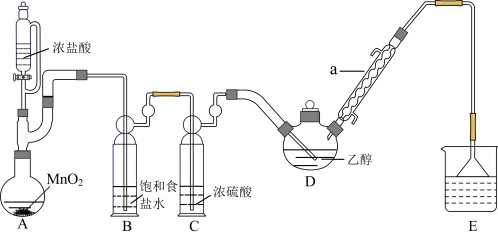
6 . 三氯乙醛(CCl3CHO)是无色油状液体,是制取农药的常用原料。某探究小组模拟工业生产制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
查阅资料知:①制备CCl3CHO的反应原理为: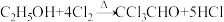 ,可能发生的副反应有:
,可能发生的副反应有: ;
; 。
。
②有关物质的性质:
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ ,仪器a的作用是_______ 。
(2)实验时,应维持装置D的反应温度为70℃左右,装置D采用较合理的加热方式是_______ ,若发现D中导管口处气泡速率过快,合理的解决方法是_______ 。
(3)若撤去装置C会导致CCl3CHO产率降低,原因是_______ 。
(4)从反应后的混合物中获得CCl3CHO粗产品,应采取的实验操作方法是_______ 。
(5)粗产品纯度的测定:
Ⅰ.称取m g CCl3CHO(相对分子质量为147.5)粗产品,配成待测溶液,然后用酸式滴定管量取xmL0.100mol·L-1碘标准溶液加入待测溶液,再加入适量碳酸钠溶液,使反应: 、
、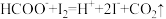 充分进行;
充分进行;
Ⅱ.再加适量盐酸调节溶液的pH,并立即用0.020mol·L-1Na2S2O3溶液滴定至终点,发生反应: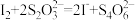 ;
;
Ⅲ.重复上述操作3次,平均消耗Na2S2O3溶液ymL。测得产品的纯度为_______ ,下列情况可能导致产品纯度的测量值偏小的是_______ (填标号)。
a.量取碘标准液时,酸式滴定管未用碘标准液润洗
b.在滴定终点读数时,俯视标准液液面
c.Na2S2O3溶液部分被氧化
d.步骤Ⅱ加入盐酸调节溶液pH,调节后溶液pH过低

查阅资料知:①制备CCl3CHO的反应原理为:
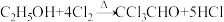 ,可能发生的副反应有:
,可能发生的副反应有: ;
; 。
。②有关物质的性质:
| 物质 | C2H5OH | CCl3 CHO | CCl3COOH | C2H5Cl |
| 熔点/℃ | -114.1 | -57.1 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(1)装置A中发生反应的离子方程式为
(2)实验时,应维持装置D的反应温度为70℃左右,装置D采用较合理的加热方式是
(3)若撤去装置C会导致CCl3CHO产率降低,原因是
(4)从反应后的混合物中获得CCl3CHO粗产品,应采取的实验操作方法是
(5)粗产品纯度的测定:
Ⅰ.称取m g CCl3CHO(相对分子质量为147.5)粗产品,配成待测溶液,然后用酸式滴定管量取xmL0.100mol·L-1碘标准溶液加入待测溶液,再加入适量碳酸钠溶液,使反应:
 、
、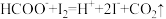 充分进行;
充分进行;Ⅱ.再加适量盐酸调节溶液的pH,并立即用0.020mol·L-1Na2S2O3溶液滴定至终点,发生反应:
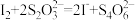 ;
;Ⅲ.重复上述操作3次,平均消耗Na2S2O3溶液ymL。测得产品的纯度为
a.量取碘标准液时,酸式滴定管未用碘标准液润洗
b.在滴定终点读数时,俯视标准液液面
c.Na2S2O3溶液部分被氧化
d.步骤Ⅱ加入盐酸调节溶液pH,调节后溶液pH过低
您最近一年使用:0次
解题方法
7 . 苯甲酸甲酯常用于配制香水、香精和人造精油,也可用作有机合成中间体、溶剂、食品保鲜剂等。用如图1所示装置制取少量苯甲酸甲酯。相关物质的物理性质如表所示。
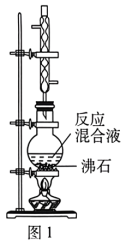

请回答下列问题:
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入 苯甲酸和
苯甲酸和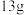 甲醇,再加入
甲醇,再加入 浓硫酸,混匀后,投入几粒沸石,小心加热
浓硫酸,混匀后,投入几粒沸石,小心加热 ,获得苯甲酸甲酯粗产品。
,获得苯甲酸甲酯粗产品。
(1)圆底烧瓶中加入沸石的目的是___________ ;如果在实验过程中发现忘记加沸石,接下来的操作是_________________________________ 。
(2)写出该实验中制取苯甲酸甲酯的化学方程式:______________________ 。
(3)该实验中使用过量的甲醇的目的是______________________ 。
II.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、浓硫酸、苯甲酸和水等,现用如图2所示流程进行精制:
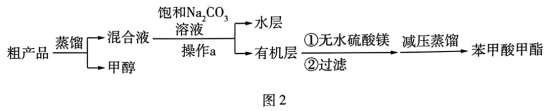
(4)第一次蒸馏时,温度应控制在___________  。
。
(5)加入饱和 溶液的目的是
溶液的目的是______________________ ;操作a的名称是___________ 。
(6)实验制得的苯甲酸甲酯精制品的质量为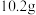 ,则苯甲酸甲酯的产率为
,则苯甲酸甲酯的产率为___________ 。


| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
相对分子质量 | 122 | 32 | 136 |
熔点/ | 122 |
|
|
沸点/ | 249 | 65 | 198 |
水溶性 | 微溶 | 易溶 | 不溶 |
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入
 苯甲酸和
苯甲酸和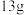 甲醇,再加入
甲醇,再加入 浓硫酸,混匀后,投入几粒沸石,小心加热
浓硫酸,混匀后,投入几粒沸石,小心加热 ,获得苯甲酸甲酯粗产品。
,获得苯甲酸甲酯粗产品。(1)圆底烧瓶中加入沸石的目的是
(2)写出该实验中制取苯甲酸甲酯的化学方程式:
(3)该实验中使用过量的甲醇的目的是
II.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、浓硫酸、苯甲酸和水等,现用如图2所示流程进行精制:

(4)第一次蒸馏时,温度应控制在
 。
。(5)加入饱和
 溶液的目的是
溶液的目的是(6)实验制得的苯甲酸甲酯精制品的质量为
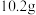 ,则苯甲酸甲酯的产率为
,则苯甲酸甲酯的产率为
您最近一年使用:0次
解题方法
8 . 乙酰苯胺可用作止痛剂、防腐剂等。实验室通过如下方法制备、提纯乙酰苯胺。已知:
I.粗乙酰苯胺的制备
制备原理: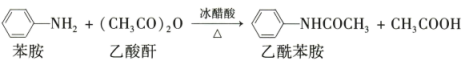 。
。
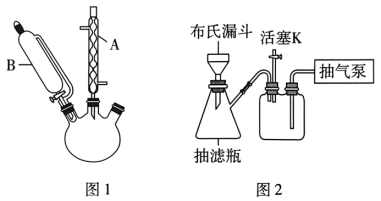
实验装置如图1所示(夹持装置略)。
实验步骤:将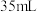 (
( )乙酸酐、
)乙酸酐、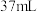 (
(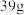 )冰醋酸加入三颈烧瓶中,在仪器B中加入
)冰醋酸加入三颈烧瓶中,在仪器B中加入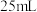 (
( )苯胺,逐滴滴加到三颈烧瓶中,边滴边搅拌,滴加完毕后小火加热
)苯胺,逐滴滴加到三颈烧瓶中,边滴边搅拌,滴加完毕后小火加热 。在搅拌下,趁热把反应混合物慢慢倒入
。在搅拌下,趁热把反应混合物慢慢倒入 冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。
冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。
II.乙酰苯胺的提纯
①将粗乙酰苯胺晶体加入盛有 热水的烧杯中,加热至沸,使之溶解。
热水的烧杯中,加热至沸,使之溶解。
②稍冷却后,加入适量粉末状活性炭,充分搅拌后趁热进行抽滤。
③将滤液转移到干净烧杯中,冷却、抽滤,用少量冷水洗涤、抽滤。
④将产物放在干净的表面皿中晾干、称重,质量为 。
。
回答下列问题:
(1)仪器A的名称是___________ ,其作用为______________________ 。
(2)本实验所用三颈烧瓶的适宜规格为___________  (填标号)。
(填标号)。
A.100 B.250 C.500
(3)制备乙酰苯胺粗品过程中,将反应混合物倒入冷水中的目的是_________________ 。
(4)提纯过程中步骤②中加入活性炭的目的是________________ 。
(5)用图2所示装置进行提纯过程中步骤③中的抽滤和洗涤。请按正确的操作顺序补充完整(只进行一次洗涤操作):打开抽气泵→转移混合物至布氏漏斗→关闭活塞K→确认抽干→打开活塞K→___________ →___________ →确认抽干→打开活塞K→关闭抽气泵。本实验多次采用抽滤操作,其优点是________ 。
(6)本实验中乙酰苯胺的产率为___________ %(保留三位有效数字)。
| 苯胺 | 乙酸酐 | 冰醋酸 | 乙酰苯胺 |
沸点为 ,微溶于水,易被氧化而变色。相对分子质量为93 ,微溶于水,易被氧化而变色。相对分子质量为93 | 沸点为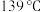 ,相对分子质量为102 ,相对分子质量为102 | 沸点为 ,相对分子质量为60 ,相对分子质量为60 | 无色晶体,沸点为 ,难溶于冷水,易溶于乙醇等有机溶剂,相对分子质量为135 ,难溶于冷水,易溶于乙醇等有机溶剂,相对分子质量为135 |
制备原理:
 。
。实验装置如图1所示(夹持装置略)。

实验步骤:将
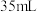 (
( )乙酸酐、
)乙酸酐、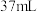 (
(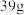 )冰醋酸加入三颈烧瓶中,在仪器B中加入
)冰醋酸加入三颈烧瓶中,在仪器B中加入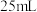 (
( )苯胺,逐滴滴加到三颈烧瓶中,边滴边搅拌,滴加完毕后小火加热
)苯胺,逐滴滴加到三颈烧瓶中,边滴边搅拌,滴加完毕后小火加热 。在搅拌下,趁热把反应混合物慢慢倒入
。在搅拌下,趁热把反应混合物慢慢倒入 冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。
冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。II.乙酰苯胺的提纯
①将粗乙酰苯胺晶体加入盛有
 热水的烧杯中,加热至沸,使之溶解。
热水的烧杯中,加热至沸,使之溶解。②稍冷却后,加入适量粉末状活性炭,充分搅拌后趁热进行抽滤。
③将滤液转移到干净烧杯中,冷却、抽滤,用少量冷水洗涤、抽滤。
④将产物放在干净的表面皿中晾干、称重,质量为
 。
。回答下列问题:
(1)仪器A的名称是
(2)本实验所用三颈烧瓶的适宜规格为
 (填标号)。
(填标号)。A.100 B.250 C.500
(3)制备乙酰苯胺粗品过程中,将反应混合物倒入冷水中的目的是
(4)提纯过程中步骤②中加入活性炭的目的是
(5)用图2所示装置进行提纯过程中步骤③中的抽滤和洗涤。请按正确的操作顺序补充完整(只进行一次洗涤操作):打开抽气泵→转移混合物至布氏漏斗→关闭活塞K→确认抽干→打开活塞K→
(6)本实验中乙酰苯胺的产率为
您最近一年使用:0次
名校
解题方法
9 . 邻硝基苯酚(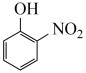 )、对硝基苯酚(
)、对硝基苯酚(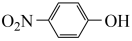 )是两种用途广泛的有机合成中间体,实验室可用苯酚(
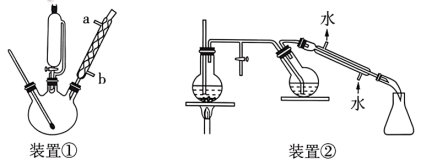
)是两种用途广泛的有机合成中间体,实验室可用苯酚(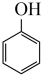 )通过硝化反应制得。实验步骤和相关装置如图所示(其中夹持仪器和控温装置已省略)。
)通过硝化反应制得。实验步骤和相关装置如图所示(其中夹持仪器和控温装置已省略)。
I.在常温下,向装置①中的三颈烧瓶中先加入 ,再加入a.蒸馏水;b.浓硫酸。
,再加入a.蒸馏水;b.浓硫酸。
II.称取一定量苯酚,与少量温水混合,并冷却至室温。
III.在搅拌下,将苯酚水溶液从恒压滴液漏斗滴入三颈烧瓶中,使反应温度维持在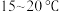 。
。
IV.加完苯酚水溶液后,继续搅拌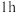 ,冷却至黑色油状物固化,倾出酸层,然后用蒸馏水洗涤数次。
,冷却至黑色油状物固化,倾出酸层,然后用蒸馏水洗涤数次。
V.邻硝基苯酚的收集:将油层利用装置②进行水蒸气蒸馏,得邻硝基苯酚粗品。
VI.对硝基苯酚的收集:在水蒸气蒸馏的残液中,先加适量蒸馏水,再加浓盐酸和少量活性炭,加热煮沸,趁热过滤、冷却结晶,分离得对硝基苯酚粗品。
已知:室温下,邻硝基苯酚、对硝基苯酚在水中的溶解度较小,邻硝基苯酚能随水蒸气一同馏出。
回答下列问题:
(1)装置①、②中都使用了冷凝管,其中装置①中冷凝管的主要作用是___________ ,该冷凝管的进水口是___________ (填字母)。
(2)装置①中硝化反应放出较多热量,容易发生副反应,需要控制温度在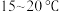 ,使用的方法是
,使用的方法是___________ 。
(3)装置①中加入试剂的先后顺序为___________ (填标号)。
A.ab B.ba
实验中生成 ,写出得到邻硝基苯酚的化学方程式:
,写出得到邻硝基苯酚的化学方程式:___________ 。
(4)利用装置②进行水蒸气蒸馏时,少量邻硝基苯酚晶体会凝结在冷凝管内壁造成堵塞,可以采取的简便措施为_________________________________ 。
(5)步骤VI中趁热过滤的目的是______________________ 。
 )、对硝基苯酚(
)、对硝基苯酚( )是两种用途广泛的有机合成中间体,实验室可用苯酚(
)是两种用途广泛的有机合成中间体,实验室可用苯酚( )通过硝化反应制得。实验步骤和相关装置如图所示(其中夹持仪器和控温装置已省略)。
)通过硝化反应制得。实验步骤和相关装置如图所示(其中夹持仪器和控温装置已省略)。
I.在常温下,向装置①中的三颈烧瓶中先加入
 ,再加入a.蒸馏水;b.浓硫酸。
,再加入a.蒸馏水;b.浓硫酸。II.称取一定量苯酚,与少量温水混合,并冷却至室温。
III.在搅拌下,将苯酚水溶液从恒压滴液漏斗滴入三颈烧瓶中,使反应温度维持在
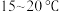 。
。IV.加完苯酚水溶液后,继续搅拌
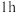 ,冷却至黑色油状物固化,倾出酸层,然后用蒸馏水洗涤数次。
,冷却至黑色油状物固化,倾出酸层,然后用蒸馏水洗涤数次。V.邻硝基苯酚的收集:将油层利用装置②进行水蒸气蒸馏,得邻硝基苯酚粗品。
VI.对硝基苯酚的收集:在水蒸气蒸馏的残液中,先加适量蒸馏水,再加浓盐酸和少量活性炭,加热煮沸,趁热过滤、冷却结晶,分离得对硝基苯酚粗品。
已知:室温下,邻硝基苯酚、对硝基苯酚在水中的溶解度较小,邻硝基苯酚能随水蒸气一同馏出。
回答下列问题:
(1)装置①、②中都使用了冷凝管,其中装置①中冷凝管的主要作用是
(2)装置①中硝化反应放出较多热量,容易发生副反应,需要控制温度在
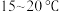 ,使用的方法是
,使用的方法是(3)装置①中加入试剂的先后顺序为
A.ab B.ba
实验中生成
 ,写出得到邻硝基苯酚的化学方程式:
,写出得到邻硝基苯酚的化学方程式:(4)利用装置②进行水蒸气蒸馏时,少量邻硝基苯酚晶体会凝结在冷凝管内壁造成堵塞,可以采取的简便措施为
(5)步骤VI中趁热过滤的目的是
您最近一年使用:0次
2023-01-14更新
|
616次组卷
|
4卷引用:突破超重点 高效突破综合实验 实验2 有机物制备实验
名校
解题方法
10 . 苯甲酸是一种重要的化工产品,在25℃和95℃下在水中的溶解度分别为0.3 g和6.9 g。实验室制备苯甲酸并测定其纯度的步骤如下:
I.苯甲酸的制备
量取一定量的甲苯和足量
 溶液发生反应:
溶液发生反应: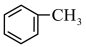 +2KMnO4
+2KMnO4
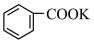 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
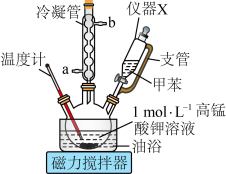
(1)仪器X的名称为_______ ,冷凝管的出水口为_______ (填“a”或“b”)。
(2)三颈烧瓶中反应基本完成的现象为_______ ,用油浴加热的优点是_______ 。
(3)“滤渣”的主要成分为_______ (填化学式);每得到1 mol滤渣,理论上转移的电子的物质的量为_______ mol。
(4)酸化时,_______ (填“能”或“不能”)用冰醋酸代替浓硫酸,理由是_______ 。
II.纯度测定
(5)称取0.10 g样品,溶于15 mL NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为_______ ,若第二次滴定过程中,滴定管起始有气泡,滴定终点时气泡消失,则导致所测得样品中苯甲酸的纯度_______ (填“偏高”、“偏低”或“不变”)。
I.苯甲酸的制备
量取一定量的甲苯和足量

 溶液发生反应:
溶液发生反应: +2KMnO4
+2KMnO4
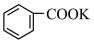 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
(1)仪器X的名称为
(2)三颈烧瓶中反应基本完成的现象为
(3)“滤渣”的主要成分为
(4)酸化时,
II.纯度测定
(5)称取0.10 g样品,溶于15 mL
 NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
您最近一年使用:0次
2023-01-14更新
|
174次组卷
|
3卷引用:河北省邯郸市部分学校2022-2023学年高三上学期期末考试化学试题