解题方法
1 . 按要求回答下列问题:
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有___________ (填字母,下同),属于酸性氧化物的有___________ 。
②Fe2(SO4)3溶于水的电离方程式为___________ 。
③写出实验室制取Fe(OH)3胶体的离子方程式:___________ 。
④写出H与足量A反应的离子方程式:___________ 。
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:___________ 。

②该反应中的还原剂为___________ (填化学式),被还原的物质与被氧化的物质的物质的量之比为___________ 。
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=___________ 。
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有
②Fe2(SO4)3溶于水的电离方程式为
③写出实验室制取Fe(OH)3胶体的离子方程式:
④写出H与足量A反应的离子方程式:
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:

②该反应中的还原剂为
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为
 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=
您最近一年使用:0次
名校
解题方法
2 . 下列离子反应方程式正确的是
A.氯气通入冷的石灰乳: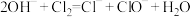 |
B.向NaHCO3溶液中滴入少量澄清石灰水: |
C.向明矾溶液中滴加Ba(OH)2溶液到 恰好完全沉淀时: 恰好完全沉淀时: |
| D.向FeI2溶液中通入少量氯气:Cl2 + 2I- = 2Cl- + I2 |
您最近一年使用:0次
名校
3 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠溶液反应):
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是___________ (填序号)。
(2)测定过程中发生反应的离子方程式为:___________ 、___________ 。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
①配制上述的稀盐酸时,需要选取的主要玻璃仪器有酸式滴定管(可量取液体体积精确到0.01mL的仪器)、烧杯、玻璃棒、___________ 。
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是___________ 。
③下列操作会导致配制的盐酸浓度偏低的是___________ 。
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为___________ 。
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为:
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.02 | 13.22 | 12.98 | 13.00 |
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是
③下列操作会导致配制的盐酸浓度偏低的是
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为
您最近一年使用:0次
解题方法
4 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)现有铁和铜的混合物,可以通过___________ 把他们分开。
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:___________ 。
反应后的废液中含有Fe3+,可以用___________ 检验。
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。___________ ,黄绿色气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式___________ 。
(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________ 。
(1)现有铁和铜的混合物,可以通过
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:
反应后的废液中含有Fe3+,可以用
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
您最近一年使用:0次
解题方法
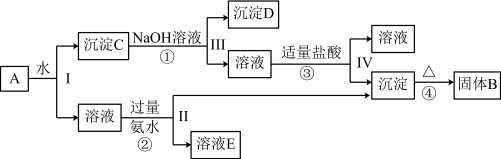
5 . 某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是___________ 。
(2)写出KAl(SO4)2在水中的电离方程式___________ 。
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B___________ ;沉淀D___________ ;溶液E是K2SO4和___________ 。
(4)写出①②反应的离子方程式。
①___________ 。
②___________ 。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
(2)写出KAl(SO4)2在水中的电离方程式
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B
(4)写出①②反应的离子方程式。
①
②
您最近一年使用:0次
解题方法
6 . 氯化钠是日常生活必需品和重要的化工原料。
(1)NaCl固体是否属于电解质?______ ,是否能导电?______ (填写“是”或“否”)。
(2)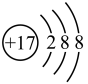 表示
表示______ 。
A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO 等可溶性杂质。
等可溶性杂质。
①写出NaCl溶于水时的电离方程式______ 。
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和______ 。
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为_______ 。
如图是某品牌“84消毒液”的使用注意事项。
②注意事项4“易使有色衣物脱色”,是因为“84消毒液”具有______ 。
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式_______ 。
(1)NaCl固体是否属于电解质?
(2)
 表示
表示A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO
 等可溶性杂质。
等可溶性杂质。①写出NaCl溶于水时的电离方程式
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为
如图是某品牌“84消毒液”的使用注意事项。
| 注意事项 1、外用消毒液,勿口服; 2、现用现配,使用时注意戴手套防护; 3、不适用于钢和铝制品的消毒; 4、易使有色衣物脱色; 5、避光、阴凉处保存; 6、不可与酸性物质同时使用. |
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式
您最近一年使用:0次
解题方法
7 . 铁及其化合物在生产、生活中有重要作用。回答下列问题:
I.硫酸亚铁晶体 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:

(1)证明经步骤①得到的滤液中含有 的方法如下:取样,先滴加
的方法如下:取样,先滴加___________ ,再滴加少量氯水,该过程的现象为___________ 。
(2)步骤②加入氯水发生反应的离子方程式是___________ 。
(3)步骤③产生的红褐色物质成分是___________ (写化学式)。
(4)步骤④中一系列操作为___________ 、洗涤、干燥、灼烧。
(5)若所取补血剂质量为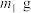 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为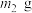 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为___________ (用含 、
、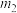 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。
II.高铁酸钾 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:

(6)过程①制取1mol ,理论上需要
,理论上需要 物质的量为
物质的量为___________ ,步骤②中反应能够发生的原因是___________ ,分离出 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有___________ 。
I.硫酸亚铁晶体
 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
(1)证明经步骤①得到的滤液中含有
 的方法如下:取样,先滴加
的方法如下:取样,先滴加(2)步骤②加入氯水发生反应的离子方程式是
(3)步骤③产生的红褐色物质成分是
(4)步骤④中一系列操作为
(5)若所取补血剂质量为
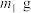 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为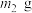 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为 、
、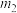 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。II.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
(6)过程①制取1mol
 ,理论上需要
,理论上需要 物质的量为
物质的量为 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
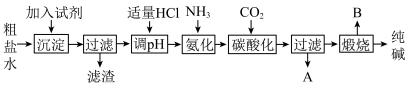
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间的转化关系如图所示(部分产物和反应条件省略).

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B______ 、丙______ .
(2)写出下列反应的离子方程式:
反应①______ ;
反应④______ .
(3)黄绿色气体乙的用途______ (列举一例即可)

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B
(2)写出下列反应的离子方程式:
反应①
反应④
(3)黄绿色气体乙的用途
您最近一年使用:0次
10 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应: ,其中作氧化剂的是
,其中作氧化剂的是______ (填化学式,下同),被还原的是______ 。
(2)中国古代著作中有“银针验毒”的记录,其原理为 ,则X的化学式是
,则X的化学式是______ ,其中 在该反应中
在该反应中______ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为______ 。
②结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为______ 。
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应:
 ,其中作氧化剂的是
,其中作氧化剂的是(2)中国古代著作中有“银针验毒”的记录,其原理为
 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为
②结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次



