名校
1 . 某同学用 与浓盐酸反应制备纯净的
与浓盐酸反应制备纯净的 的装置如图所示。回答下列问题:
的装置如图所示。回答下列问题:
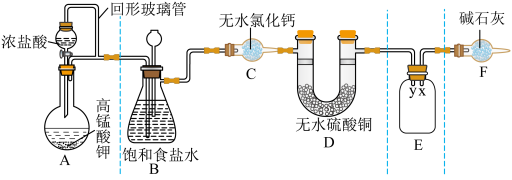
已知: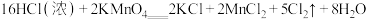
(1)装置A中盛放浓盐酸的仪器名称是
(2)E装置中导管(填“x”或“y”)
(3)装置F的作用有两个:一是
请写出氯气与碱石灰反应的化学方程式
(4)
 、HClO和
、HClO和 三种微粒的物质的量分数随pH(即
三种微粒的物质的量分数随pH(即 )变化的关系如图所示。
)变化的关系如图所示。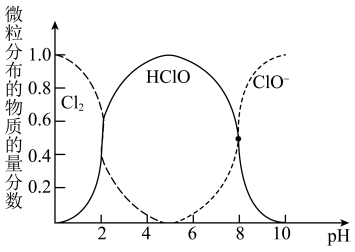
回答问题:①使用84消毒液时为增强消毒效果常调节4<pH<6,原因是
②通常购买的84消毒液pH在12左右,为增强消毒效果可向其中滴加
A.可口可乐 B.稀 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸
(5)实验室将
 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为 ,计算此时所得溶液中NaClO的质量分数为
,计算此时所得溶液中NaClO的质量分数为
您最近一年使用:0次
2 . 如图为实验室某浓盐酸试剂瓶标签上的部分数据,试根据标签.上的相关数据回答下列问题:.
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:______ ;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:______ 。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是______ 。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
名校
解题方法
3 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有Al2O3、Fe2O3、FeO、SiO2等)来制备绿矾(FeSO4•7H2O)和氧化铝,其工艺流程如图:
回答下列问题:
(1)滤渣1的成分是_______ ,举例说明滤渣2的用途 _______ 。
(2)用离子方程式表示溶液A加入过量铁粉的目的是_______ 。
(3)写出由滤液1生成滤液2的离子方程式_______ 。
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有_______ 。
(5)过程3需要加入的试剂A是_______ ,写出此过程的离子方程式 _______ 。

回答下列问题:
(1)滤渣1的成分是
(2)用离子方程式表示溶液A加入过量铁粉的目的是
(3)写出由滤液1生成滤液2的离子方程式
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有
(5)过程3需要加入的试剂A是
您最近一年使用:0次
名校
解题方法
4 . 某小组为探究 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。

(1)在实验进行的过程中,应该持续通入氮气的目的是___________ 。
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明 的热分解产物中一定含有
的热分解产物中一定含有___________ 。
(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入 溶液变红,说明
溶液变红,说明___________ 。
(4)已知: 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
完成下列小题:
①若反应后 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸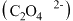 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式___________ 。
②据此计算出该 固体的纯度为
固体的纯度为___________ (保留一位有效数字) 。
③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是___________ 。
 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(1)在实验进行的过程中,应该持续通入氮气的目的是
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明
 的热分解产物中一定含有
的热分解产物中一定含有(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入
 溶液变红,说明
溶液变红,说明(4)已知:
 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。完成下列小题:
①若反应后
 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸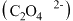 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式②据此计算出该
 固体的纯度为
固体的纯度为③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴
 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是
您最近一年使用:0次
名校
解题方法
5 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,·些水管的活塞会“自动”熔化,喷出水来。由一种铋矿[主要成分为 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
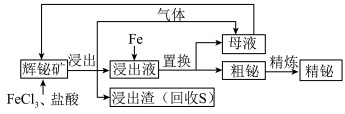
已知:酸性条件下的氧化性: 。
。
(1)“浸出”过程中,溶液中放出的气体是_________ ;放出该气体的离子方程式是________ 。
(2)加入 溶液的目的是
溶液的目的是___________ ,该反应的离子方程式是___________ 。
(3)检验母液中所含有的主要金属阳离子的方法是___________ 。
(4)铋的+5价盐类(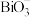 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究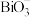 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:
据图回答下面的问题:
①上述试剂的氧化性强弱顺序为:___________ 。
②写出 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向_________ ,已知 不溶于水。)
不溶于水。)
 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
已知:酸性条件下的氧化性:
 。
。(1)“浸出”过程中,溶液中放出的气体是
(2)加入
 溶液的目的是
溶液的目的是(3)检验母液中所含有的主要金属阳离子的方法是
(4)铋的+5价盐类(
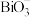 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究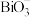 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠固体 | ②过量的双氧水 | ③加入淀粉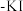 溶液 溶液 |
| 实验现象 | 溶液呈现紫红色 | 紫红色消失,产生气泡 | 溶液变为蓝色 |
①上述试剂的氧化性强弱顺序为:
②写出
 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向 不溶于水。)
不溶于水。)
您最近一年使用:0次
6 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域,实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
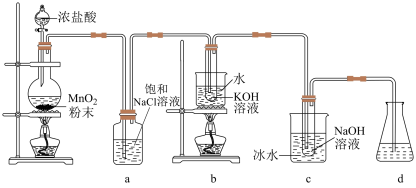
已知:温度会影响 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。
回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是___________ ,装置a的作用是___________ 。
(2)写出b中试管内反应的化学方程式___________ 。
(3)装置c采用冰水浴冷却的目的是___________ 。
(4)反应结束后,取出b中试管,经蒸发浓缩,___________ ,___________ ,少量冷水洗涤,干燥,得到 晶体。
晶体。
(5)设计实验探究 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。
因此, 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO的氧化能力。
(6) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: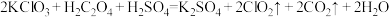 。
。
①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:___________
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为___________ 。(计算结果保留两位小数)
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响
 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是
(2)写出b中试管内反应的化学方程式
(3)装置c采用冰水浴冷却的目的是
(4)反应结束后,取出b中试管,经蒸发浓缩,
 晶体。
晶体。(5)设计实验探究
 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。| 实验操作 | 现象 | |
| Ⅰ | 取  溶液,振荡。 溶液,振荡。 | 无明显变化 |
| Ⅱ | 取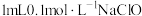 溶液于2号试管中, 溶液于2号试管中, | 出现红褐色沉淀 |
 的氧化能力
的氧化能力(6)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: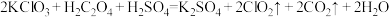 。
。①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
7 . 高铁酸钾(K2FeO4)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
回答下列问题:
(1)写出①中发生反应的离子方程式:___________ 。
(2)②中加入NaOH固体的目的是___________(填字母序号)。
(3)完成④中反应的离子方程式:___________ ,氧化剂与氧化产物的物质的量之比为___________ ;若反应每生成lmol 转移电子的数目为:
转移电子的数目为:___________ 。
(4)从溶液II中得到K2FeO4晶体的操作是___________ 、洗涤、千燥。
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。

| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(1)写出①中发生反应的离子方程式:
(2)②中加入NaOH固体的目的是___________(填字母序号)。
| A.为后续反应提供碱性环境 |
| B.加入NaOH固体做氧化剂有利于除去NaCl |
| C.NaOH固体溶解时会放出较多的热量,有利于后续生成K2FeO4 |
| D.与溶液I中过量的Cl2继续反应,生成更多的NaClO |
(3)完成④中反应的离子方程式:
 转移电子的数目为:
转移电子的数目为:(4)从溶液II中得到K2FeO4晶体的操作是
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。
| A.KOH溶液 | B.乙醇 | C.H2O | D.FeCl2溶液 |
您最近一年使用:0次
名校
解题方法
8 . 稀土元素被称为“工业维生素”,包括钇、铈等元素,稀土元素能显著提升建造航母及舰载机的材料性能。
Ⅰ.工业上吸收SO2和NO,以获得Na2S2O4和NH4NO3产品的流程图如图(Ce为铈元素)。

(1)装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO 、NO
、NO 。请写出生成相等数目的NO
。请写出生成相等数目的NO 和NO
和NO 时的离子方程式,并用单线桥表示电子转移
时的离子方程式,并用单线桥表示电子转移_______ 。
Ⅱ.含有稀土元素钇的氧化钇(Y2O3)被广泛应用于航空航天涂层材料。以富钇稀土矿(主要成分为Y2O3,含有少量的Fe2O3、CuO、SiO2等杂质)生产氧化钇的工艺流程如图,回答下列问题:

(2)在粉碎机中研磨粉碎的目的是_______ 。
(3)流程中操作Ⅰ、Ⅱ、Ⅲ的名称是_______ ,“酸溶”过程中,Y2O3发生反应的离子方程式为_______ 。
(4)向反应釜2中通入气体X使溶液呈碱性,调节溶液的pH除去滤液1中杂质,沉淀Ⅱ的主要成分是_______ (填化学式)。
(5)流程中可循环使用的物质为_______ (填名称)。
Ⅰ.工业上吸收SO2和NO,以获得Na2S2O4和NH4NO3产品的流程图如图(Ce为铈元素)。

(1)装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO
 、NO
、NO 。请写出生成相等数目的NO
。请写出生成相等数目的NO 和NO
和NO 时的离子方程式,并用单线桥表示电子转移
时的离子方程式,并用单线桥表示电子转移Ⅱ.含有稀土元素钇的氧化钇(Y2O3)被广泛应用于航空航天涂层材料。以富钇稀土矿(主要成分为Y2O3,含有少量的Fe2O3、CuO、SiO2等杂质)生产氧化钇的工艺流程如图,回答下列问题:

(2)在粉碎机中研磨粉碎的目的是
(3)流程中操作Ⅰ、Ⅱ、Ⅲ的名称是
(4)向反应釜2中通入气体X使溶液呈碱性,调节溶液的pH除去滤液1中杂质,沉淀Ⅱ的主要成分是
(5)流程中可循环使用的物质为
您最近一年使用:0次
名校
9 . 二氯异氰尿酸钠(NaC3N3O3Cl2)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入Cl2产生高浓度NaClO溶液,然后与氰尿酸(C3H3N3O3)反应制取二氯异氰尿酸钠:2NaClO+C3H3N3O3=NaC3N3O3Cl2+NaOH+H2O。
(1)从下面选择所需装置完成实验,按气流从左至右,导管口连接顺序为______ (填小写字母)。
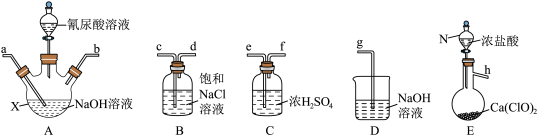
(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为_________ 。
(3)装置A中制备NaClO溶液完成的现象是___________ ,在加氰尿酸溶液过程仍需不断通入Cl2的理由是___________ 。
(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为: +H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O,
+H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O, ,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。
,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。
①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒外,还需要___________ 。
②二氯异氰尿酸钠优质品要求有效氯大于60%,通过计算判断该样品是否为优质品________ 。( 该样品的有效氯  )(写出计算过程)
)(写出计算过程)
③若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值______ (填“偏高”或“偏低”)。
(5)高铁酸钾是一种重要的多功能绿色净水剂,暗紫色具有金属光泽的粉末,无臭无味,干燥品在室温下稳定,在强碱溶液中稳定。
①配平K2FeO4与水反应的化学方程式,并用单线桥标出电子转移方向和数目________ 。___K2FeO4+____H2O=___Fe(OH)3胶体+____O2↑+____KOH,被还原的元素是___________ 。
②结合高铁酸钾的性质,说明它是一种多功能绿色净水剂的原因:_________ 。
(1)从下面选择所需装置完成实验,按气流从左至右,导管口连接顺序为

(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为
(3)装置A中制备NaClO溶液完成的现象是
(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为:
 +H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O,
+H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O, ,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。
,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒外,还需要
②二氯异氰尿酸钠优质品要求有效氯大于60%,通过计算判断该样品是否为优质品
 )(写出计算过程)
)(写出计算过程)③若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值
(5)高铁酸钾是一种重要的多功能绿色净水剂,暗紫色具有金属光泽的粉末,无臭无味,干燥品在室温下稳定,在强碱溶液中稳定。
①配平K2FeO4与水反应的化学方程式,并用单线桥标出电子转移方向和数目
②结合高铁酸钾的性质,说明它是一种多功能绿色净水剂的原因:
您最近一年使用:0次
10 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
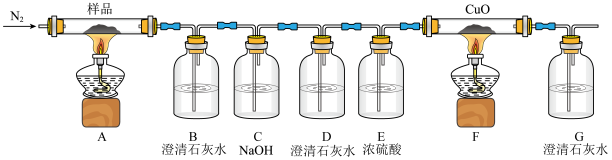
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
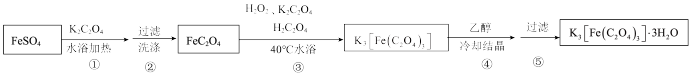
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
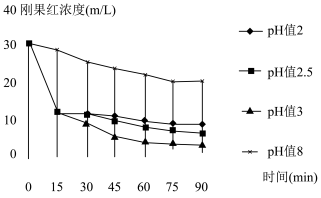
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次



