1 . 高铁酸钾(K2FeO4)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(已知:Fe3++3H2O⇌Fe(OH)3+3H+)
(1)高铁酸钾可用于杀菌消毒,是因为它具有强___________ 性。
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为________ 。这种分散系区分于其他分散系的最本质区别是_________ 。
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______ +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。
①完成上述离子方程式:___________ 。
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
湿法制备高铁酸钾的流程如下图。
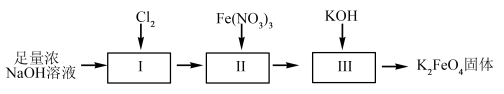
(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。___________ ,反应每生成1molCl-转移的电子数目为___________ 。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

(1)高铁酸钾可用于杀菌消毒,是因为它具有强
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______
 +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。①完成上述离子方程式:
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为
湿法制备高铁酸钾的流程如下图。

(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

| A.24℃,75g∙L-1 | B.26℃,75g∙L-1 | C.28℃,75g∙L-1 | D.22℃,80g∙L-1 |
您最近一年使用:0次
2 . 某含铬矿石的回收生产中得到BaCrO4的样品,为了测定其中BaCrO4的含量,进行以下实验: =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应
1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为_____ (用字母表示)。
2.若加入的HI溶液过量太多,测定结果会_____。
3.用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4) 2与Ce2 (SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是_____。
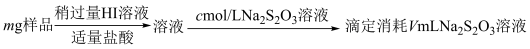
 =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为
2.若加入的HI溶液过量太多,测定结果会_____。
| A.偏高 | B.偏低 | C.无影响 | D.无法确定 |
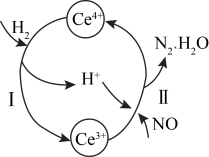
| A.反应I的离子反应方程式为:2Ce4++H2=2Ce3++2H+ |
| B.反应II中氧化剂与还原剂的物质的量之比为1:2 |
| C.反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+) |
| D.反应过程中混合溶液内Ce3+和Ce4+的总数一定保持不变 |
您最近一年使用:0次
名校
解题方法
3 . 以废铁屑(含少量 FeS等杂质)为原料,制备硫酸亚铁晶体
FeS等杂质)为原料,制备硫酸亚铁晶体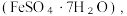 流程示意图如下:
流程示意图如下: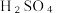 的作用是
的作用是
_________ (用离子方程式表示)。过程中产生的有毒气体,可用___________ 溶液吸收。
(2)酸浸时间对所得溶液的成分影响如下表所示。
用文字说明导致上述颜色变化的可能原因。___________
(3)已知: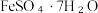 受热易失水,则操作X为:蒸发浓缩、
受热易失水,则操作X为:蒸发浓缩、________ 、过滤、洗涤。FeSO4强热后继续分解,推测产物为___________ 、Fe2O3和SO3。
测定所得硫酸亚铁晶体中的含量,步骤如下:
Ⅰ.称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ.取出10mL溶液,加入适量稀硫酸,滴入 的
的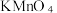 溶液,至反应完全,共消耗
溶液,至反应完全,共消耗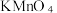 溶液cmL。(反应原理:
溶液cmL。(反应原理:
(4)计算硫酸亚铁晶体样品中 质量分数
质量分数___________ 。
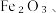 FeS等杂质)为原料,制备硫酸亚铁晶体
FeS等杂质)为原料,制备硫酸亚铁晶体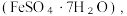 流程示意图如下:
流程示意图如下:
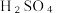 的作用是
的作用是
(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 | 1min | 30min | 120min |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
(3)已知:
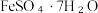 受热易失水,则操作X为:蒸发浓缩、
受热易失水,则操作X为:蒸发浓缩、测定所得硫酸亚铁晶体中的含量,步骤如下:
Ⅰ.称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ.取出10mL溶液,加入适量稀硫酸,滴入
 的
的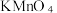 溶液,至反应完全,共消耗
溶液,至反应完全,共消耗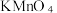 溶液cmL。(反应原理:
溶液cmL。(反应原理:
(4)计算硫酸亚铁晶体样品中
 质量分数
质量分数
您最近一年使用:0次
21-22高一下·上海浦东新·期中
名校
解题方法
4 . 铁元素在化合物中有多种化合价,常见的有+2,+3价。
Ⅰ.某溶液中有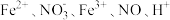 和
和 六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
(1)请写出该反应的离子方程式___________ 。
(2)该反应中氧化剂与还原剂的物质的量之比为___________ ;产生2mol还原产物时转移电子的总数为___________ 。
Ⅱ.磁铁矿的主要成分是 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
①取少量磁铁矿石样品,加入过量的试剂A溶解。
②验证:
取溶解后的液体少许,加入少量试剂B,观察现象。
③验证:
取溶解后的液体少许,加入少量试剂C,观察现象。
(3)试剂A为___________ ,发生反应的离子方程式为___________ 。
(4)试剂B为___________ ,观察到___________ ,则证明有 。
。
(5)试剂C为___________ ,观察到___________ ,则证明有 。
。
Ⅰ.某溶液中有
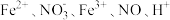 和
和 六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
六种粒子,分别属于同一氧化还原反应中的反应物和生成物。(1)请写出该反应的离子方程式
(2)该反应中氧化剂与还原剂的物质的量之比为
Ⅱ.磁铁矿的主要成分是
 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:①取少量磁铁矿石样品,加入过量的试剂A溶解。
②验证:

取溶解后的液体少许,加入少量试剂B,观察现象。
③验证:

取溶解后的液体少许,加入少量试剂C,观察现象。
(3)试剂A为
(4)试剂B为
 。
。(5)试剂C为
 。
。
您最近一年使用:0次
2013·上海徐汇·二模
解题方法
5 . (1)三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式_________ 。
(2)加入过量的KMnO4才能将水中的三氯乙烯彻底除去。已知n(KMnO4):n(C2HCl3)=5:1时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为1×10-4g/L,计算每处理1m3该地下水,需KMnO4_______ g。
(2)加入过量的KMnO4才能将水中的三氯乙烯彻底除去。已知n(KMnO4):n(C2HCl3)=5:1时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为1×10-4g/L,计算每处理1m3该地下水,需KMnO4
您最近一年使用:0次



