解题方法
1 . 实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取4.86 g样品溶于水,配成500 mL溶液。加入0.50 mol/L Ba(OH)2溶液至100.00 mL时沉淀量达到最大。请计算:
(1)25℃时0.50 mol/L Ba(OH)2溶液中的氢氧根离子浓度是_______ mol/L。
(2)样品中n(NaHCO3)∶n(Na2CO3)=_______ 。
(1)25℃时0.50 mol/L Ba(OH)2溶液中的氢氧根离子浓度是
(2)样品中n(NaHCO3)∶n(Na2CO3)=
您最近一年使用:0次
2023高三·全国·专题练习
2 . 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为_______ 。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
您最近一年使用:0次
21-22高一·全国·假期作业
3 . Na2O2是一种重要化工原料,工业上可以用来漂白纺织类物品、麦秆、纤维等。回答下列问题:
(1)Na2O2中氧元素化合价为_______ ,写出过氧化钠与水反应的化学方程式_______ 。
(2)过氧化钠若长期保存不当,容易生成_______ (填化学式),证明过氧化钠变质情况的一种实验方案如下。
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下_______ m3空气(只需列出计算表达式,已知氧气占空气体积分数约为20%,空气的密度为1.293g/cm3)。
(1)Na2O2中氧元素化合价为
(2)过氧化钠若长期保存不当,容易生成
| 操作 | 现象 | 结论 |
| 取少量样品于试管中,加水溶解,加入 | 有白色沉淀生成 | |
| 另取少量样品于试管中,再加入适量的水,用带火星的木条靠近管口 | 带火星的木条复燃 |
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下
您最近一年使用:0次
名校
4 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
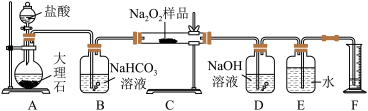
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
548次组卷
|
5卷引用:人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验
人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
2022高三·全国·专题练习
5 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。某学习小组在实验室对高铁酸钾的制备和一些性质进行探究。用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,_______ 。
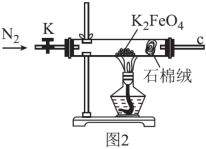

您最近一年使用:0次
2019高三·全国·专题练习
解题方法
6 . 硫的多种化合物在工业中有重要的应用。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为________ 。
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1∶2时,产物为________ (填化学式)。
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,SO2气体被还原成Na2S2O4。该反应的化学方程式为______________
(2)铬会造成环境污染。某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为_________
②处理后的废水中Cr3+的物质的量浓度为________ mol·L-1。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1∶2时,产物为
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,SO2气体被还原成Na2S2O4。该反应的化学方程式为
(2)铬会造成环境污染。某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为
②处理后的废水中Cr3+的物质的量浓度为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
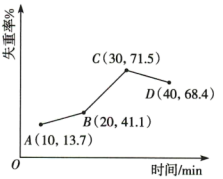
7 . 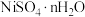 易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备
易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备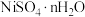 ,采用热重分析法测定所得
,采用热重分析法测定所得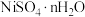 样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为
样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为___________ ;C点产物的化学式为___________ 。
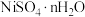 易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备
易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备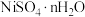 ,采用热重分析法测定所得
,采用热重分析法测定所得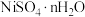 样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为
样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
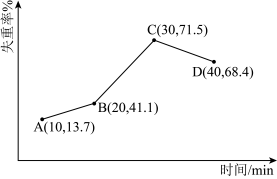
8 . 采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为_______ ;C点产物的化学式为_______ 。

您最近一年使用:0次
名校
解题方法
9 . 按照要求回答下列问题。
(1)已知下列七种物质:①NaCl②Cu③SO2④氯化铁溶液⑤稀硫酸⑥硫酸钡⑦熔融KNO3,其中属于电解质的是____ 。
(2)工业中常将钠块加入正己烷中,除去微量的水,反应的化学方程式为____ ;若将23g钠与一定量的水发生上述反应,最终形成1L的溶液,其溶液的物质的量浓度为____ ,同时生成的气体在标准状况下的体积为____ 。
(3)利用焰色试验的原理既可制作五彩缤纷的节日烟花,也可定性鉴别某些金属盐,立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。灼烧立德粉样品时,钡的焰色为____ 。
(4)工业废水中含有的重铬酸根离子(Cr2O )有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O
)有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。
+14H+=6Fe3++2Cr3++7H2O。
①在该反应中还原产物是____ (填离子符号);
②用单线桥标出该反应电子转移的方向和数目____ 。
(1)已知下列七种物质:①NaCl②Cu③SO2④氯化铁溶液⑤稀硫酸⑥硫酸钡⑦熔融KNO3,其中属于电解质的是
(2)工业中常将钠块加入正己烷中,除去微量的水,反应的化学方程式为
(3)利用焰色试验的原理既可制作五彩缤纷的节日烟花,也可定性鉴别某些金属盐,立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。灼烧立德粉样品时,钡的焰色为
| A.黄色 | B.砖红色 | C.紫色 | D.黄绿色 |
(4)工业废水中含有的重铬酸根离子(Cr2O
 )有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O
)有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。
+14H+=6Fe3++2Cr3++7H2O。①在该反应中还原产物是
②用单线桥标出该反应电子转移的方向和数目
您最近一年使用:0次
2022-03-19更新
|
150次组卷
|
2卷引用:海南省海口市第一中学2021-2022学年高一上学期12月月考化学试题
10 . NaNO2易溶于水,外观和食盐相似,有咸味,人误食会中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请回答下列问题:
(1)已知HI和HCl性质相似。上述反应的离子方程式为_______ 。
(2)上述反应中NaI_______ (填序号)。
①是氧化产物 ②是还原产物
③既不是氧化产物,又不是还原产物 ④既是氧化产物,又是还原产物
(3)根据上述反应可鉴别NaNO2和NaCl。可选用的物质有:
①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋
你认为应该选用的物质有_______ (填序号)。
(4)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_______ (填序号)。
A.NaCl B.NH4Cl C.HNO3
(5)NaNO2也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品纯度,所涉及到的反应有:
(a) NO +MnO
+MnO +H+ →NO
+H+ →NO +Mn2+ +H2O
+Mn2+ +H2O
(b) MnO + H2C2O4+ H+ → Mn2+ + CO2↑+ H2O
+ H2C2O4+ H+ → Mn2+ + CO2↑+ H2O
①配平反应(a) _______NO + _______MnO
+ _______MnO + _______H+ = _______NO
+ _______H+ = _______NO + _______Mn2+ + _______H2O
+ _______Mn2+ + _______H2O
_______
②误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是_______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(1)已知HI和HCl性质相似。上述反应的离子方程式为
(2)上述反应中NaI
①是氧化产物 ②是还原产物
③既不是氧化产物,又不是还原产物 ④既是氧化产物,又是还原产物
(3)根据上述反应可鉴别NaNO2和NaCl。可选用的物质有:
①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋
你认为应该选用的物质有
(4)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3
(5)NaNO2也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品纯度,所涉及到的反应有:
(a) NO
 +MnO
+MnO +H+ →NO
+H+ →NO +Mn2+ +H2O
+Mn2+ +H2O(b) MnO
 + H2C2O4+ H+ → Mn2+ + CO2↑+ H2O
+ H2C2O4+ H+ → Mn2+ + CO2↑+ H2O①配平反应(a) _______NO
 + _______MnO
+ _______MnO + _______H+ = _______NO
+ _______H+ = _______NO + _______Mn2+ + _______H2O
+ _______Mn2+ + _______H2O②误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
您最近一年使用:0次



