2023高三·全国·专题练习
解题方法
1 . 硫氰化钾( )是中学化学实验室的常见药品。某实验小组测定制备的晶体中
)是中学化学实验室的常见药品。某实验小组测定制备的晶体中 的含量:称取
的含量:称取 样品,配成
样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用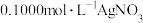 标准溶液滴定,滴定时发生反应:
标准溶液滴定,滴定时发生反应: (白色),平均消耗
(白色),平均消耗 标准溶液
标准溶液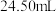 。
。
(1)刚好沉淀完时,锥形瓶中溶液的颜色变化是_______ 。
(2)晶体中 的质量分数为
的质量分数为_______ 。
 )是中学化学实验室的常见药品。某实验小组测定制备的晶体中
)是中学化学实验室的常见药品。某实验小组测定制备的晶体中 的含量:称取
的含量:称取 样品,配成
样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用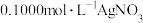 标准溶液滴定,滴定时发生反应:
标准溶液滴定,滴定时发生反应: (白色),平均消耗
(白色),平均消耗 标准溶液
标准溶液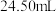 。
。(1)刚好沉淀完时,锥形瓶中溶液的颜色变化是
(2)晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
2 . 阅读并分析体检报告,可以初步判断体检者的身体状况。
(1)在图中所示的体检报告中,表示葡萄糖指标的物理量是___________ (填字母)。
a.质量分数 b.溶解度 c.摩尔质量 d.物质的量浓度
(2)查看自己或家人的体检报告,哪些项目的指标是用物质的量浓度表示的?___________
(3)检测人的血液中葡萄糖(简称血糖,葡萄糖的相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值为3.9~6.1mmol/L。如果以“mg/dL”表示,血糖正常值范围是___________ ?若某人的血糖检测结果为92mg/dL,他(她)的血糖正常吗?___________
(1)在图中所示的体检报告中,表示葡萄糖指标的物理量是
序号 | 项目名称 | 英文缩写 | 检查结果 | 单位 | 参考范围 |
12 | *钾 | K | 4.1 | mmol/L | 3.5-5.5 |
13 | *钠 | Na | 140 | mmol/L | 135-145 |
14 | *氯 | Cl | 103 | mmol/L | 96-111 |
15 | 钙 | Ca | 0.68 | mmol/L | 2.13-2.70 |
16 | 胱抑素 | CyaC | 0.78 | mg/L | 0.59-1.03 |
18 | *尿素 | Urea | 4.18 | mmol/L | 2.78-7.14 |
19 | *葡萄糖 | Glu | 5.1 | mmol/L | 3.9-6.1 |
21 | *无机磷 | P | 1.19 | mmol/L | 0.81-1.45 |
22 | *总胆固醇 | TC | 4.65 | mmol/L | 2.85-5.70 |
23 | *甘油三酯 | TG | 1.50 | mmol/L | 0.45-1.70 |
24 | 高密度脂蛋白胆固醇 | HDL-V | 1.08 | mmol/L | 0.93-1.83 |
(2)查看自己或家人的体检报告,哪些项目的指标是用物质的量浓度表示的?
(3)检测人的血液中葡萄糖(简称血糖,葡萄糖的相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值为3.9~6.1mmol/L。如果以“mg/dL”表示,血糖正常值范围是
您最近一年使用:0次
21-22高一上·全国·课时练习
3 . 如图为各元素在地壳中含量的质量分数:

问题:金属元素在地壳中的含量远小于非金属元素,结合初中化学所学,概括金属的物理性质和化学性质。___________

问题:金属元素在地壳中的含量远小于非金属元素,结合初中化学所学,概括金属的物理性质和化学性质。
您最近一年使用:0次
名校
4 . 液氯储罐中常混有NCl3,当液氯中NCl3的质量分数达到4%以上就有爆炸危险。为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为: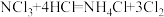 )。再用400mL6.1mol/L的NaOH溶液(
)。再用400mL6.1mol/L的NaOH溶液(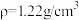 )吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内
)吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内 质量为0.270g。
质量为0.270g。
(1)计算上述NaOH溶液的质量分数______ 。
(2)计算该样品中NCl3的质量分数,并判断该样品是否安全______ ?
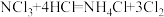 )。再用400mL6.1mol/L的NaOH溶液(
)。再用400mL6.1mol/L的NaOH溶液(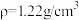 )吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内
)吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内 质量为0.270g。
质量为0.270g。(1)计算上述NaOH溶液的质量分数
(2)计算该样品中NCl3的质量分数,并判断该样品是否安全
您最近一年使用:0次
2021-11-18更新
|
128次组卷
|
2卷引用:上海市复旦大学附属中学2021学年高一上学期期中考试化学试题
5 . 腐殖质是土壤中结构复杂的有机物,土壤肥力与腐殖质含量密切相关。可采用重铬酸钾法测定土壤中腐殖质的含量:称取0.1500 g风干的土样,加入5 mL0. 10 mol·L-1K2Cr2O7的H2SO4溶液,充分加热,氧化其中的碳(C→CO2,腐殖质中含碳58% , 90%的碳可被氧化)。以邻菲罗啉为指示剂,用0.1221 mol·L-1的(NH4)2SO4 ·FeSO4溶液滴定,消耗10.02 mL。空白实验如下:上述土壤样品经高温灼烧后,称取同样质量,采用相同的条件处理和滴定,消耗(NH4)2SO4·FeSO4溶液22.35mL。
(1)写出在酸性介质中K2Cr2O7,将碳氧化为CO2的方程式_____ 。
(1)写出硫酸亚铁铵滴定过程的方程式______ 。
(3)计算土壤中腐殖质的质量分数____ 。
(1)写出在酸性介质中K2Cr2O7,将碳氧化为CO2的方程式
(1)写出硫酸亚铁铵滴定过程的方程式
(3)计算土壤中腐殖质的质量分数
您最近一年使用:0次
名校
6 . 大苏打 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程___________ 。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为___________ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因___________ 。
(3)下列关于苏打和小苏打的说法正确的是___________ (选填字母序号)。
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。

请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是___________ (填写化学式)
②滴入 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性___________ (填“增强”或“减弱”),试解释其原因___________ 。
③原 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为___________ 。
 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向
 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是
②滴入
 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性③原
 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为
您最近一年使用:0次
2021-02-09更新
|
1017次组卷
|
7卷引用:河南省信阳市2021届高三上学期第二次教学质量检测化学试题
河南省信阳市2021届高三上学期第二次教学质量检测化学试题(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第1讲 钠及其重要化合物新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题
20-21高一上·浙江·阶段练习
7 . 表是某人在医院血液生化检查时,化验单的部分内容:
已知:1摩尔(mol)等于1000毫摩尔(mmol),血液中葡萄糖简称血糖,分子式为C6H12O6,请根据以上信息回答下列问题:
(1)这个人的血糖含量属___________ (填“正常”、“偏高”或“偏低”)
(2)上表中的血液化验单各项指标的物理量是___________ (填字母)
A.质量分数B.溶解度C.摩尔质量D.物质的量浓度
(3)这个人的1mL血液中含葡萄糖___________ g。(有解题过程,否则不得分)
| 项目名称 | 数据 | 参考值 |
| 尿素氮 | 3.95 | 2.00-6.10mmol·L-1 |
| 葡萄糖 | 4.50 | 3.89-6.11mmol·L-1 |
| 总胆固醇 | 3.80 | <5.20mmol·L-1 |
| 甘油三酯 | 1.85↑ | <1.70mmol·L-1 |
(1)这个人的血糖含量属
(2)上表中的血液化验单各项指标的物理量是
A.质量分数B.溶解度C.摩尔质量D.物质的量浓度
(3)这个人的1mL血液中含葡萄糖
您最近一年使用:0次
8 . 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒(Se)可能成为环境污染物,可通过与浓HNO3或浓H2SO4反应后,经SO2还原来回收Se。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出化学方程式:__ 。
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O(Ⅰ)
2SO2+SeO2+2H2O=Se+2SO +4H+(Ⅱ)
+4H+(Ⅱ)
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是__ 。
(3)可以通过下面的方法测定回收得到的SeO2样品中SeO2的含量:
①SeO2+KI+HNO3=Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,用双线桥标出电子转移的方向和数目___ 。
(4)按(3)中的方法测定SeO2的含量。实验中,准确称量SeO2样品0.1500g,消耗0.2000mol•L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为___ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出化学方程式:
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O(Ⅰ)
2SO2+SeO2+2H2O=Se+2SO
 +4H+(Ⅱ)
+4H+(Ⅱ)SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)可以通过下面的方法测定回收得到的SeO2样品中SeO2的含量:
①SeO2+KI+HNO3=Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,用双线桥标出电子转移的方向和数目
(4)按(3)中的方法测定SeO2的含量。实验中,准确称量SeO2样品0.1500g,消耗0.2000mol•L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为
您最近一年使用:0次
9 . 在短周期元素中,(均用化学符号表示)
(1)常温下有颜色的气体单质有___________ ;
(2)除稀有气体外,原子半径最大的元素是____ ;最小的元素是____ ;
(3)气态氢化物中最稳定的是___ ,含氢的质量分数最大的是___ ,其水溶液呈碱性的元素是___ ;
(4)在最高价氧化物中呈最高正价的元素是____ ;
(5)地壳中含量最多的元素____ 。
(1)常温下有颜色的气体单质有
(2)除稀有气体外,原子半径最大的元素是
(3)气态氢化物中最稳定的是
(4)在最高价氧化物中呈最高正价的元素是
(5)地壳中含量最多的元素
您最近一年使用:0次
名校
10 . Ⅰ.碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。写出该反应的化学方程式:_________ 。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是______________ 。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为2Cu2I2+Hg===Cu2HgI4(玫瑰红)+2Cu,产物Cu2HgI4中Cu元素显_______ 价,当有1molCu2I2参与反应时,转移电子数目______ 。
Ⅱ、过氧化钙可以用于改善地表水质,为测定过氧化钙产品中CaO2的含量,进行如下的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。(已知:I2+2S2O32-=2I-+S4O62-)
(4)第一步发生反应的化学方程式为______________________________ ;
(5)样品中CaO2的质量分数为____________ (用字母表示)。
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。写出该反应的化学方程式:
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为2Cu2I2+Hg===Cu2HgI4(玫瑰红)+2Cu,产物Cu2HgI4中Cu元素显
Ⅱ、过氧化钙可以用于改善地表水质,为测定过氧化钙产品中CaO2的含量,进行如下的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。(已知:I2+2S2O32-=2I-+S4O62-)
(4)第一步发生反应的化学方程式为
(5)样品中CaO2的质量分数为
您最近一年使用:0次



