名校
1 . 阅读下列短文,并回答相关问题。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个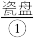 内盛一条被
内盛一条被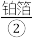 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点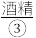 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点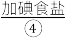 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。
(1)物质①~④中,属于单质的有______ (填序号,下同),属于化合物的有______ ,属于混合物的有______ 。
(2)酒精的分子式为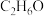 ,燃烧时的化学方程式为
,燃烧时的化学方程式为______ ,酒精中 的质量分数为
的质量分数为______ (用百分数表示,保留3位数字),已知物质碳元素含量较高时,在空气中燃烧时冒黑烟。乙醇在空气中充分燃烧时火焰为淡蓝色的原因可能是______ 。
(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作______ 有关。
(4)已知淀粉遇碘单质 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸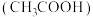 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:______ 。
宴会上有一道菜肴烤鲜鱼。服务员手捧一个
 内盛一条被
内盛一条被 严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点
严严实实裹着的烤熟了的鲑鱼。为了保温,服务员在瓷盘内倒一点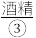 ,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点
,然后用火柴将酒精点着。此时,服务员在铝箔上撒一点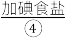 ,只见火焰呈现鲜明的橙黄色。
,只见火焰呈现鲜明的橙黄色。(1)物质①~④中,属于单质的有
(2)酒精的分子式为
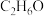 ,燃烧时的化学方程式为
,燃烧时的化学方程式为 的质量分数为
的质量分数为(3)已知铝燃烧发出耀眼的白光,撒一点食盐后火焰呈黄色与化学定性操作
(4)已知淀粉遇碘单质
 会变为蓝色,某学生为了检验食盐中的碘酸钾
会变为蓝色,某学生为了检验食盐中的碘酸钾 ,往食盐中加入少量
,往食盐中加入少量 溶液与醋酸
溶液与醋酸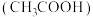 ,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
,再加入淀粉溶液,发现溶液变为蓝色,试写出发生反应的离子方程式:
您最近一年使用:0次
2023-12-26更新
|
57次组卷
|
2卷引用:江西省鹰潭市2023-2024学年高一上学期11月期中化学试题
解题方法
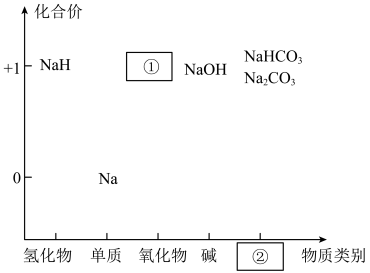
2 . 价类二维图是我们学习元素及其化合物相关知识的重要模型和工具。如图是钠的价类二维图: 中氢元素的化合价为
中氢元素的化合价为___________ , 能与水剧烈反应:
能与水剧烈反应: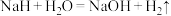 ,该反应中氧化剂和还原剂的物质的量之比是
,该反应中氧化剂和还原剂的物质的量之比是___________ 。
(2)某同学欲进行钠在空气中燃烧的实验,可将钠放入___________ (填字母)中进行加热。
A.蒸发皿 B.坩埚
(3)若①是一种淡黄色固体,其在呼吸面具中作供氧剂的原理是___________ (用化学方程式表示,写一个即可)。
(4)检验上图中物质所含钠元素的方法___________ 。
(5)某纯碱样品中含杂质 ,取质量为
,取质量为 的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到
的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到 固体物质,则此样品中
固体物质,则此样品中 的质量分数为
的质量分数为___________ 。
 中氢元素的化合价为
中氢元素的化合价为 能与水剧烈反应:
能与水剧烈反应: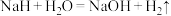 ,该反应中氧化剂和还原剂的物质的量之比是
,该反应中氧化剂和还原剂的物质的量之比是(2)某同学欲进行钠在空气中燃烧的实验,可将钠放入
A.蒸发皿 B.坩埚
(3)若①是一种淡黄色固体,其在呼吸面具中作供氧剂的原理是
(4)检验上图中物质所含钠元素的方法
(5)某纯碱样品中含杂质
 ,取质量为
,取质量为 的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到
的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到 固体物质,则此样品中
固体物质,则此样品中 的质量分数为
的质量分数为
您最近一年使用:0次
3 . 化学计量在化学中占有重要地位,请回答下列问题:
(1)质量分数为30%的硫酸溶液和10%的硫酸溶液等体积混合,则混合溶液的质量分数______ 20%(填“>”、“<”或“=”)
(2)在标准状况下,含有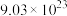 个氦原子的氦气的体积约为
个氦原子的氦气的体积约为______ 。
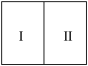
(3)如下图所示,气缸的总体积一定,内部被活塞隔成Ⅰ、Ⅱ两部分,活塞可以自由移动,也可以固定。标准状况下,向Ⅰ中充入16g ,Ⅱ中充入8g
,Ⅱ中充入8g ,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为
,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为______ 。
(4)准确称取6.00克铝土矿样品(含 、
、 ,
, ),将其放入盛有100mL
),将其放入盛有100mL 溶液的烧杯中,充分反应后滤出沉淀物
溶液的烧杯中,充分反应后滤出沉淀物 。在滤液X中加入10mol/L的NaOH,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
。在滤液X中加入10mol/L的NaOH,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
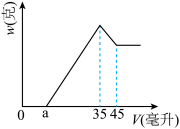
①分析图象可知滤液X中所含有的溶质成分为______ 。(填化学式)。 溶液的物质的量浓度是
溶液的物质的量浓度是______ 。
②若图中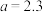 时,用于沉淀
时,用于沉淀 所消耗的NaOH溶液的体积是
所消耗的NaOH溶液的体积是______ ,铝土矿样品中 的质量分数为
的质量分数为______ , 的质量分数为
的质量分数为______ 。
③a值的变化范围是______ ,在这个范围内,a值越大,______ 的质量分数越小。
(1)质量分数为30%的硫酸溶液和10%的硫酸溶液等体积混合,则混合溶液的质量分数
(2)在标准状况下,含有
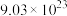 个氦原子的氦气的体积约为
个氦原子的氦气的体积约为(3)如下图所示,气缸的总体积一定,内部被活塞隔成Ⅰ、Ⅱ两部分,活塞可以自由移动,也可以固定。标准状况下,向Ⅰ中充入16g
 ,Ⅱ中充入8g
,Ⅱ中充入8g ,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为
,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为
(4)准确称取6.00克铝土矿样品(含
 、
、 ,
, ),将其放入盛有100mL
),将其放入盛有100mL 溶液的烧杯中,充分反应后滤出沉淀物
溶液的烧杯中,充分反应后滤出沉淀物 。在滤液X中加入10mol/L的NaOH,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
。在滤液X中加入10mol/L的NaOH,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
①分析图象可知滤液X中所含有的溶质成分为
 溶液的物质的量浓度是
溶液的物质的量浓度是②若图中
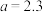 时,用于沉淀
时,用于沉淀 所消耗的NaOH溶液的体积是
所消耗的NaOH溶液的体积是 的质量分数为
的质量分数为 的质量分数为
的质量分数为③a值的变化范围是
您最近一年使用:0次
4 . 我国科学家侯德榜发明了联合制碱法。以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,又称“侯氏制碱法”,对世界制碱工业作出了卓越贡献。根据要求回答下列问题:
I、用纯净的碳酸钠固体配制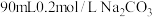 溶液。
溶液。
(1)用托盘天平称取 固体的质量是
固体的质量是_____ 
(2)本实验中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和_____ 。
(3)下列说法中,正确的是_____(填字母)。
II、生成纯碱的流程如下: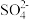 、
、 、
、 ,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量
,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量 溶液;②足量
溶液;②足量 溶液;③适量稀盐酸;④足量的
溶液;③适量稀盐酸;④足量的 溶液。则正确的试剂添加顺序_____(填字母)。
溶液。则正确的试剂添加顺序_____(填字母)。
(5)已知:
写出装置I中反应的化学方程式:_____ 。
(6)制出的纯碱中只含有杂质 ,下列实验方案中,不能测定出混合物中
,下列实验方案中,不能测定出混合物中 质量分数的是_____(填字母)。
质量分数的是_____(填字母)。
(7)将碳酸钠和碳酸氢钠的混合物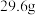 ,加热到质量不再变化时,剩余物质的质量
,加热到质量不再变化时,剩余物质的质量 ,则混合物中碳酸钠的质量分数
,则混合物中碳酸钠的质量分数_____  (精确到0.1)。
(精确到0.1)。
I、用纯净的碳酸钠固体配制
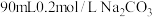 溶液。
溶液。(1)用托盘天平称取
 固体的质量是
固体的质量是
(2)本实验中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和
(3)下列说法中,正确的是_____(填字母)。
| A.定容时仰视刻度线,会导致配制的溶液浓度偏小 |
| B.定容时如果加水超过刻度线,要用滴管吸出 |
| C.摇匀后发现凹液面下降,再加水至刻度线 |
| D.转移时溶液倒出容量瓶外,要重新配制溶液 |
II、生成纯碱的流程如下:

 、
、 、
、 ,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量
,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量 溶液;②足量
溶液;②足量 溶液;③适量稀盐酸;④足量的
溶液;③适量稀盐酸;④足量的 溶液。则正确的试剂添加顺序_____(填字母)。
溶液。则正确的试剂添加顺序_____(填字母)。| A.①②③④ | B.②①④③ | C.②④①③ | D.④②①③ |
(5)已知:
 |  |  |  | |
| 溶解度(20℃) | 36.0 | 21.7 | 9.6 | 37.2 |
(6)制出的纯碱中只含有杂质
 ,下列实验方案中,不能测定出混合物中
,下列实验方案中,不能测定出混合物中 质量分数的是_____(填字母)。
质量分数的是_____(填字母)。A.取 混合物充分加热,质量减少 混合物充分加热,质量减少 |
B.取 混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 固体 固体 |
C.取 混合物与足量 混合物与足量 溶液充分反应,沉淀经过滤、洗涤、干燥得到 溶液充分反应,沉淀经过滤、洗涤、干燥得到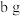 固体 固体 |
D.取 混合物与足量稀盐酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加 混合物与足量稀盐酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加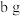 |
(7)将碳酸钠和碳酸氢钠的混合物
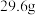 ,加热到质量不再变化时,剩余物质的质量
,加热到质量不再变化时,剩余物质的质量 ,则混合物中碳酸钠的质量分数
,则混合物中碳酸钠的质量分数 (精确到0.1)。
(精确到0.1)。
您最近一年使用:0次
2024-02-25更新
|
68次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
5 . A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
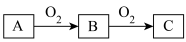
(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是___________ 、___________ ;如果是多种成分,可能是___________ 、___________ 。
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用___________ 。将C长期露置于空气中,最后将变成物质D,D的化学式为___________ 。现有D和 的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为___________ 。

(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用
 的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
您最近一年使用:0次
2023-11-30更新
|
107次组卷
|
3卷引用:江西省宜春市丰城市东煌学校2023-2024学年高三上学期12月月考化学试题
名校
6 . 根据所学知识,回答下列问题:
(1)稀硫酸具有酸性,50mL0.1mol•L-1稀硫酸溶液中,n(H+)=_______ mol。
(2)稀硫酸与铝恰好完全反应,所得0.5VmLAl2(SO4)3溶液中含有mgAl3+,将其稀释至Vml,此时溶液中SO 物质的量浓度为
物质的量浓度为_______ mol•L-1。
(3)在同温同压下,NO和SO2两种气体,密度比为_______ ,若两者质量相等,其体积比为_______ 。
(4)实验室利用反应2KClO3 2KCl+3O2↑制取氧气,现有12.25gKClO3参加反应,计算得到标准状况下的氧气的体积是
2KCl+3O2↑制取氧气,现有12.25gKClO3参加反应,计算得到标准状况下的氧气的体积是_______ L。
(5)将标准状况下的aLHCl气体溶于1L水中,得到盐酸的物质的量浓度为b mol/L,则该盐酸的质量分数为_______ ;该盐酸的密度为_______ g·mL-1。
(6)9.03×1023个H2的物质的量是_______ ,在标准状况下的体积为_______ 。实验室制H2时,用排空气法收集H2,所得气体对NO的相对密度为2/3,则H2在此气体中所占的体积分数为_______ 。(精确到小数点后1位)
(1)稀硫酸具有酸性,50mL0.1mol•L-1稀硫酸溶液中,n(H+)=
(2)稀硫酸与铝恰好完全反应,所得0.5VmLAl2(SO4)3溶液中含有mgAl3+,将其稀释至Vml,此时溶液中SO
 物质的量浓度为
物质的量浓度为(3)在同温同压下,NO和SO2两种气体,密度比为
(4)实验室利用反应2KClO3
 2KCl+3O2↑制取氧气,现有12.25gKClO3参加反应,计算得到标准状况下的氧气的体积是
2KCl+3O2↑制取氧气,现有12.25gKClO3参加反应,计算得到标准状况下的氧气的体积是(5)将标准状况下的aLHCl气体溶于1L水中,得到盐酸的物质的量浓度为b mol/L,则该盐酸的质量分数为
(6)9.03×1023个H2的物质的量是
您最近一年使用:0次
名校
7 . 回答下列问题。
Ⅰ.新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为___________  。(保留一位小数)
。(保留一位小数)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是___________ (填仪器名称)

②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是___________ 。
(3)请将下列各操作按正确的顺序将字母代号填写在横线上___________ 。
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(4)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
(5)某工厂将氯气通入到40%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
Ⅰ.新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度) 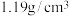 |
 。(保留一位小数)
。(保留一位小数)(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是

②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是
(3)请将下列各操作按正确的顺序将字母代号填写在横线上
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(4)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
| A.配制前,容量瓶中有少量蒸馏水 | B.洗涤液未转移到容量瓶中 |
| C.未经冷却立即转液 | D.定容时,仰视溶液的凹液面 |
您最近一年使用:0次
解题方法
8 . 完成下列计算
(1)23gNa含有的电子的数目为_______ 。
(2)9.03×1023个H2分子,在标准状况下占有的体积约为_______ L。
(3)同温同压下,34gNH3和32gO2的体积比为_______ 。
(4)同温同体积时,容器甲装有4gH2乙容器装有14gN2,甲、乙两容器中气体的压强比为_______ 。
(5)同温同压下,32gSO2与44gCO2的密度比为_______ 。
(6)质量分数为36.5%的HCl溶液,密度为1.19g/cm3,该HCl溶液的物质的量浓度为_______ 。
(7)某气体在标准状况下的密度为1.25g/L,该气体的摩尔质量为_______ 。
(8)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_______ 。
(9)有A、B两种元素,已知元素A的核电荷数为a,且A3-与Bn+的电子排布完全相同,则元素B的核电荷数为_______ 。
(1)23gNa含有的电子的数目为
(2)9.03×1023个H2分子,在标准状况下占有的体积约为
(3)同温同压下,34gNH3和32gO2的体积比为
(4)同温同体积时,容器甲装有4gH2乙容器装有14gN2,甲、乙两容器中气体的压强比为
(5)同温同压下,32gSO2与44gCO2的密度比为
(6)质量分数为36.5%的HCl溶液,密度为1.19g/cm3,该HCl溶液的物质的量浓度为
(7)某气体在标准状况下的密度为1.25g/L,该气体的摩尔质量为
(8)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为
(9)有A、B两种元素,已知元素A的核电荷数为a,且A3-与Bn+的电子排布完全相同,则元素B的核电荷数为
您最近一年使用:0次
名校
9 . 自古至今,铁及其化合物在人类生产生活中的使用发挥了巨大的作用。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是___________ (填化学式) 。
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式___________ 。
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):
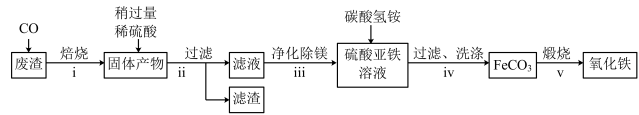
提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是___________ (填化学式)。
②步骤Ⅴ中,发生反应的化学方程式为___________ 。
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为___________ 。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):

提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是
②步骤Ⅴ中,发生反应的化学方程式为
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为
您最近一年使用:0次
2023-07-10更新
|
309次组卷
|
2卷引用:江西省宁冈中学2023-2024学年高二上学期开学考试化学试题
10 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制 盐酸和
盐酸和 溶液;
溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用 溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
④加入 盐酸。
盐酸。
请回答下列问题:
(1)正确的操作顺序是_______ (填序号)。
(2)测定过程中发生反应的离子方程式为_______ ;_______ 。
(3)如图为实验室某浓盐酸试剂瓶上的标签的有关内容,该浓盐酸中溶质的物质的量浓度为_______  。
。

用该浓盐酸配制本实验所需的 盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、
盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、_______ (从下列图中选择,写出名称)。

下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶在使用前未干燥,里面有少量蒸馏水:_______ ;
②未洗涤烧杯及玻璃棒:_______ 。
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为_______ 。
①配制
 盐酸和
盐酸和 溶液;
溶液;②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用
 溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;④加入
 盐酸。
盐酸。请回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为
(3)如图为实验室某浓盐酸试剂瓶上的标签的有关内容,该浓盐酸中溶质的物质的量浓度为
 。
。
用该浓盐酸配制本实验所需的
 盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、
盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、
下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶在使用前未干燥,里面有少量蒸馏水:
②未洗涤烧杯及玻璃棒:
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.00 | 12.90 | 13.10 | 13.00 |
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为
您最近一年使用:0次



