名校
1 . 胆矾(CuSO4·5H2O)又名蓝矾,是化学工业、医药领域中的常见物质。某实验小组利用有色金属加工企业的废材制得粗胆矾晶体。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加_______ 至过量,先析出沉淀,后沉淀部分溶解,过滤得深蓝色溶液,滤渣为红褐色;
③另取少量①所得溶液,加入足量的_______ 溶液,出现白色沉淀;
④取③中所得上层清液,加入_______ 溶液,无明显现象。
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-= ;I2+2Na2S2O3=2NaI+Na2S4O6
;I2+2Na2S2O3=2NaI+Na2S4O6
请回答:步骤①中,加入足量NaF溶液的可能原因是_______ ,若不加NaF溶液,可导致最终的测量值_______ (填 “偏大”“偏小”或“无影响”)。滴加KI溶液生成沉淀的离子方程式为_______ ; 若Na2S2O3标准溶液的平均用量为10.00 mL,则产品中胆矾的质量分数为_______ 。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加
③另取少量①所得溶液,加入足量的
④取③中所得上层清液,加入
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-=
 ;I2+2Na2S2O3=2NaI+Na2S4O6
;I2+2Na2S2O3=2NaI+Na2S4O6请回答:步骤①中,加入足量NaF溶液的可能原因是
您最近一年使用:0次
名校
解题方法
2 . 某纯碱样品中含有少量氯化钠杂质,取12g该样品,加100g稀盐酸恰好完全反应,得到107.6g溶液。
(1)反应的化学方程式为______ 。
(2)得到溶液的质量与反应前物质总质量相比______ (填“减小”、“增加”或“不变”)。
(3)反应后溶液中的溶质为______ (填化学式),质量为______ g。
(4)该纯碱样品中碳酸钠的质量分数为______ 。(计算结果精确到0.1%)
(1)反应的化学方程式为
(2)得到溶液的质量与反应前物质总质量相比
(3)反应后溶液中的溶质为
(4)该纯碱样品中碳酸钠的质量分数为
您最近一年使用:0次
名校
3 . 现有以下几种物质(或微粒):
①铜丝;②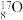 ;③
;③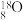 ;④液态
;④液态 ;⑤
;⑤ 溶液;⑥熔融
溶液;⑥熔融 ;⑦冰醋酸;⑧饱和
;⑦冰醋酸;⑧饱和 溶液;⑨“84”消毒液。
溶液;⑨“84”消毒液。
回答下列问题:
(1)以上物质中属于分散系的是___________ (填序号)。
(2)⑤中溶质熔融状态的电离方程式为___________ 。
(3)向⑤中逐滴加入 溶液至中性,其离子方程式为
溶液至中性,其离子方程式为___________ 。
(4)“84”消毒液稀释一定比例后能有效杀灭病毒。某同学购买了一瓶“84”消毒液,消毒液包装说明如图所示。某化学实验小组参阅该“84”消毒液的配方,欲用 固体配制
固体配制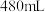 该“84”消毒液。
该“84”消毒液。
①“84”消毒液中 的物质的量浓度为
的物质的量浓度为___________ 。需要称量 固体的质量为
固体的质量为___________ g。
②用到的仪器有天平、药匙、烧杯、玻璃棒、量筒、___________ 和___________ 。
③下列情况中,会使所配溶液浓度偏低的是___________ (填标号)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.定容摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
d.容量瓶用蒸馏水洗净后,没烘干就用于溶液配制
①铜丝;②
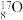 ;③
;③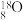 ;④液态
;④液态 ;⑤
;⑤ 溶液;⑥熔融
溶液;⑥熔融 ;⑦冰醋酸;⑧饱和
;⑦冰醋酸;⑧饱和 溶液;⑨“84”消毒液。
溶液;⑨“84”消毒液。回答下列问题:
(1)以上物质中属于分散系的是
(2)⑤中溶质熔融状态的电离方程式为
(3)向⑤中逐滴加入
 溶液至中性,其离子方程式为
溶液至中性,其离子方程式为(4)“84”消毒液稀释一定比例后能有效杀灭病毒。某同学购买了一瓶“84”消毒液,消毒液包装说明如图所示。某化学实验小组参阅该“84”消毒液的配方,欲用
 固体配制
固体配制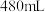 该“84”消毒液。
该“84”消毒液。| 84消毒液 有效成分:  规格: 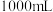 质量分数:20% 密度:  稀释100倍(体积比)后使用 |
 的物质的量浓度为
的物质的量浓度为 固体的质量为
固体的质量为②用到的仪器有天平、药匙、烧杯、玻璃棒、量筒、
③下列情况中,会使所配溶液浓度偏低的是
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.定容摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
d.容量瓶用蒸馏水洗净后,没烘干就用于溶液配制
您最近一年使用:0次
名校
4 . 生活离不开化学。家庭厨卫中有许多中学化学常见的物质,下列物质括号内为厨卫物品的主要成分:①食盐 ;②料酒(乙醇);③食醋(乙酸);④碱面
;②料酒(乙醇);③食醋(乙酸);④碱面 ;⑤发酵粉(
;⑤发酵粉( 和酒石酸);⑥“84”消毒液
和酒石酸);⑥“84”消毒液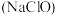 ;⑦洁厕灵
;⑦洁厕灵 。回答下列问题:
。回答下列问题:
(1)写出 在水中的电离方程式:
在水中的电离方程式:_______ 。
(2)当食盐不慎洒落在天然气的火焰上,观察到的现象是_______ 。
(3)②③的主要成分可以归为一类物质,其分类的依据是_______ (填标号)。
A.两种物质都是电解质
B.两种物质都是含碳化合物
C.两种物质都是氧化物
(4)⑥和⑦不能混合使用的原因是_______ (用离子方程式表示)。
(5)用面粉制作馒头的发酵过程中会产生有机酸(一种弱酸),导致口感变差,若在蒸馒头前加入适量④,可使蒸好的馒头松软可口无酸味,用化学方程式解释④的作用:_______ (设有机酸化学式为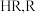 表示有机酸根)。
表示有机酸根)。
(6)欲用 固体配制
固体配制 质量分数为25%、密度为
质量分数为25%、密度为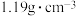 的“84”消毒液。
的“84”消毒液。
①用电子天平(精确度为 )称量
)称量 的质量为
的质量为_______ g,若配制过程中发现液面超过了刻度线,处理方法为_______ 。
②该“84”消毒液的物质的量浓度约为_______  (保留小数点后一位)。
(保留小数点后一位)。
 ;②料酒(乙醇);③食醋(乙酸);④碱面
;②料酒(乙醇);③食醋(乙酸);④碱面 ;⑤发酵粉(
;⑤发酵粉( 和酒石酸);⑥“84”消毒液
和酒石酸);⑥“84”消毒液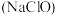 ;⑦洁厕灵
;⑦洁厕灵 。回答下列问题:
。回答下列问题:(1)写出
 在水中的电离方程式:
在水中的电离方程式:(2)当食盐不慎洒落在天然气的火焰上,观察到的现象是
(3)②③的主要成分可以归为一类物质,其分类的依据是
A.两种物质都是电解质
B.两种物质都是含碳化合物
C.两种物质都是氧化物
(4)⑥和⑦不能混合使用的原因是
(5)用面粉制作馒头的发酵过程中会产生有机酸(一种弱酸),导致口感变差,若在蒸馒头前加入适量④,可使蒸好的馒头松软可口无酸味,用化学方程式解释④的作用:
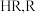 表示有机酸根)。
表示有机酸根)。(6)欲用
 固体配制
固体配制 质量分数为25%、密度为
质量分数为25%、密度为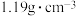 的“84”消毒液。
的“84”消毒液。①用电子天平(精确度为
 )称量
)称量 的质量为
的质量为②该“84”消毒液的物质的量浓度约为
 (保留小数点后一位)。
(保留小数点后一位)。
您最近一年使用:0次
名校
解题方法
5 . A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
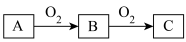
(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是___________ 、___________ ;如果是多种成分,可能是___________ 、___________ 。
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用___________ 。将C长期露置于空气中,最后将变成物质D,D的化学式为___________ 。现有D和 的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为___________ 。

(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用
 的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
您最近一年使用:0次
2023-11-30更新
|
107次组卷
|
3卷引用:安徽省合肥市第一中学肥东分校2023-2024学年高一上学期期末考试化学试卷
解题方法
6 . 实验室有一瓶敞口放置一段时间的氢氧化钠固体,为测定该瓶样品中氢氧化钠的质量分数,现取17.3g该样品溶于足量的水中(固体完全溶解),向所得溶液中逐滴加入200g一定溶质质量分数的稀盐酸,实验过程如图所示(不考虑碳酸钠的分步反应)。
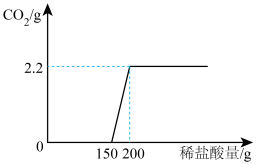
(1)经分析,该氢氧化钠固体_______ (填“部分”或“完全”)变质,恰好完全反应时,产生气体的质量为_______ g。
(2)计算样品中氢氧化钠的质量_______ (写出计算过程)。

(1)经分析,该氢氧化钠固体
(2)计算样品中氢氧化钠的质量
您最近一年使用:0次
7 . 把5.1g镁和铝的粉末放入过量的盐酸中,得到0.5gH2。
(1)该合金中铝的质量分数_______ 。
(2)该合金中铝和镁物质的量之比是_______ 。
(1)该合金中铝的质量分数
(2)该合金中铝和镁物质的量之比是
您最近一年使用:0次
名校
8 . 硫酸的工业制取原理为① ,②
,②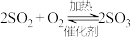 ,③
,③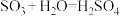 。请回答下列问题:
。请回答下列问题:
(1)请配平反应①的化学方程式:_______
 。
。
(2)标准状况下,
 的摩尔质量为
的摩尔质量为_______ ,质量为_______ g。
(3) 、120℃下,等质量的
、120℃下,等质量的 和
和 的物质的量之比为
的物质的量之比为_______ ,密度之比为_______ 。
(4)质量分数为98%的浓硫酸(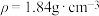 )的物质的量浓度为
)的物质的量浓度为_______  ;实验室需要配制
;实验室需要配制
 硫酸溶液,需要用量筒量取该浓硫酸的体积为
硫酸溶液,需要用量筒量取该浓硫酸的体积为_______ mL;若从配制好的硫酸溶液中取出 ,其浓度为
,其浓度为_______  ,将这
,将这 硫酸溶液稀释至
硫酸溶液稀释至 ,溶液中
,溶液中 浓度为
浓度为_______  。
。
 ,②
,②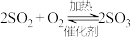 ,③
,③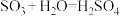 。请回答下列问题:
。请回答下列问题:(1)请配平反应①的化学方程式:
 。
。(2)标准状况下,

 的摩尔质量为
的摩尔质量为(3)
 、120℃下,等质量的
、120℃下,等质量的 和
和 的物质的量之比为
的物质的量之比为(4)质量分数为98%的浓硫酸(
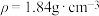 )的物质的量浓度为
)的物质的量浓度为 ;实验室需要配制
;实验室需要配制
 硫酸溶液,需要用量筒量取该浓硫酸的体积为
硫酸溶液,需要用量筒量取该浓硫酸的体积为 ,其浓度为
,其浓度为 ,将这
,将这 硫酸溶液稀释至
硫酸溶液稀释至 ,溶液中
,溶液中 浓度为
浓度为 。
。
您最近一年使用:0次
2022-12-07更新
|
208次组卷
|
3卷引用:安徽省淮北市第一中学2022-2023学年高一上学期第三次月考化学试题
名校
9 . 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素。

请用化学用语回答下列问题:
(1)E元素在周期表中的位置:___________ 。
(2)B、C、E对应的最高价含氧酸酸性由强到弱的顺序是___________ 。(用化学式表示)
(3)F与D同主族且相邻,B、D、F可形成一个三原子分子,且每个原子均达到8电子稳定结构,则该分子的结构式为___________ 。
(4)D的简单氢化物沸点高于B的氢化物沸点的原因___________ 。
(5)由元素A、E形成的物质X与由元素C和元素氢形成的化合物Y可发生以下反应:

①写出M的电子式___________ 。
②写出X溶液与Y溶液反应的离子方程式___________ 。

请用化学用语回答下列问题:
(1)E元素在周期表中的位置:
(2)B、C、E对应的最高价含氧酸酸性由强到弱的顺序是
(3)F与D同主族且相邻,B、D、F可形成一个三原子分子,且每个原子均达到8电子稳定结构,则该分子的结构式为
(4)D的简单氢化物沸点高于B的氢化物沸点的原因
(5)由元素A、E形成的物质X与由元素C和元素氢形成的化合物Y可发生以下反应:

①写出M的电子式
②写出X溶液与Y溶液反应的离子方程式
您最近一年使用:0次
名校
10 . I.铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。
我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释___________ 。
(2)电子工业中常用 溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有
溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有 ,可选择下列试剂中的
,可选择下列试剂中的___________ (填编号,下同)进行检验,现象是___________ 。
A.KSCN溶液 B.酸性 溶液 C.新制氯水
溶液 C.新制氯水
(3)高铁酸钠( )是一种新型绿色消毒剂,其一种制备原理如下:
)是一种新型绿色消毒剂,其一种制备原理如下: ,请将方程式补充完整并配平该方程式
,请将方程式补充完整并配平该方程式___________ 。
(4)在 和
和 的混合溶液中通入
的混合溶液中通入 气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程
气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程___________ 。
II.某油脂厂废弃的油脂加氢镍催化剂(主要含Ni、Al、Fe的氧化物, 、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):

(5)“转化”时,加入 的目的是
的目的是___________ (用离子方程式表示),写出Al与NaOH溶液反应的化学方程式:___________ 。
(6)取ag铁粉投入600mL某浓度的稀 溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=
溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=___________ g。
我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释
(2)电子工业中常用
 溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有
溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有 ,可选择下列试剂中的
,可选择下列试剂中的A.KSCN溶液 B.酸性
 溶液 C.新制氯水
溶液 C.新制氯水(3)高铁酸钠(
 )是一种新型绿色消毒剂,其一种制备原理如下:
)是一种新型绿色消毒剂,其一种制备原理如下: ,请将方程式补充完整并配平该方程式
,请将方程式补充完整并配平该方程式(4)在
 和
和 的混合溶液中通入
的混合溶液中通入 气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程
气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程II.某油脂厂废弃的油脂加氢镍催化剂(主要含Ni、Al、Fe的氧化物,
 、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
(5)“转化”时,加入
 的目的是
的目的是(6)取ag铁粉投入600mL某浓度的稀
 溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=
溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=
您最近一年使用:0次



