1 . 防治环境污染,改善生态环境已成为全球共识。十九大报告提出“要像对待生命一样对待生态环境”。回答下列问题:
I.大气污染
(1)汽车尾气:空气中的 、
、 在高温条件下反应生成NO的化学方程式为
在高温条件下反应生成NO的化学方程式为__________ 。
(2)工业上消除氮氧化物的污染可用如下反应: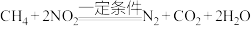 。反应中还原剂为
。反应中还原剂为__________ (填化学式);若反应中消耗 ,则转移电子的物质的量为
,则转移电子的物质的量为__________  。
。
Ⅱ.水体污染
(3)过量排放含氮元素的废水,会引起水华等水体污染问题。含有大量 的废水脱氮可以用
的废水脱氮可以用 氧化法。一定条件下,溶液pH对
氧化法。一定条件下,溶液pH对 去除
去除 能力的影响如图所示。
能力的影响如图所示。
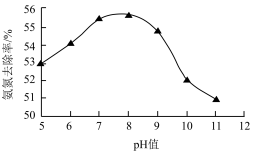
① 时,将
时,将 溶液氧化
溶液氧化 的离子方程式补充完整:
的离子方程式补充完整:_______ 。









②去除氨氮废水适宜的pH约为__________ 。
(4)测定废水中的氮含量:取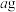 废水,将所含氮完全转化为
废水,将所含氮完全转化为 ,所得
,所得 用过量的
用过量的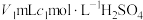 溶液吸收完全,剩余
溶液吸收完全,剩余 用
用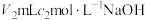 溶液恰好中和,则废水中氮元素的质量分数是
溶液恰好中和,则废水中氮元素的质量分数是__________ 。
I.大气污染
(1)汽车尾气:空气中的
 、
、 在高温条件下反应生成NO的化学方程式为
在高温条件下反应生成NO的化学方程式为(2)工业上消除氮氧化物的污染可用如下反应:
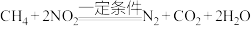 。反应中还原剂为
。反应中还原剂为 ,则转移电子的物质的量为
,则转移电子的物质的量为 。
。Ⅱ.水体污染
(3)过量排放含氮元素的废水,会引起水华等水体污染问题。含有大量
 的废水脱氮可以用
的废水脱氮可以用 氧化法。一定条件下,溶液pH对
氧化法。一定条件下,溶液pH对 去除
去除 能力的影响如图所示。
能力的影响如图所示。
①
 时,将
时,将 溶液氧化
溶液氧化 的离子方程式补充完整:
的离子方程式补充完整:








②去除氨氮废水适宜的pH约为
(4)测定废水中的氮含量:取
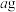 废水,将所含氮完全转化为
废水,将所含氮完全转化为 ,所得
,所得 用过量的
用过量的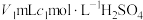 溶液吸收完全,剩余
溶液吸收完全,剩余 用
用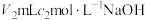 溶液恰好中和,则废水中氮元素的质量分数是
溶液恰好中和,则废水中氮元素的质量分数是
您最近一年使用:0次
名校
解题方法
2 . 工业上用 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
(1) Ca(ClO)2中Cl元素的化合价是___________ ;工业上将氯气制成漂白粉的主要目的是___________ 。工业上制成漂白粉的化学方程式:___________ 。
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
(3)浸泡衣物时加入漂粉精(有效成分Ca(ClO)2)在空气中放置一段时间漂白效果更好,请用化学方程式解释原因:___________ 。
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是___________ 。
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②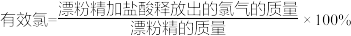 。
。
若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为___________ (计算结果保留一位小数)。
 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:(1) Ca(ClO)2中Cl元素的化合价是
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
| A.生石灰 | B.漂白粉 |
| C.NaOH | D. |
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②
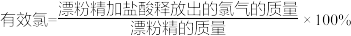 。
。若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:

(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,_______ ;
②_______ ,_______ ,Mg2++2OH-═Mg(OH)2↓;
③OH﹣+CO2= ,CO2+2H2O+AlO
,CO2+2H2O+AlO ═Al(OH)3↓+
═Al(OH)3↓+  ;
;
④_______ 。
(2)该样品中铝的质量分数是_______ 。
(3)第②步中加入NaOH溶液不足时,会使测定结果_______ (填“偏高”、“ 偏低”、“无影响”,下同);第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_______ ;第④步对沉淀灼烧不充分时,会使测定结果_______ 。

(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,
②
③OH﹣+CO2=
 ,CO2+2H2O+AlO
,CO2+2H2O+AlO ═Al(OH)3↓+
═Al(OH)3↓+  ;
;④
(2)该样品中铝的质量分数是
(3)第②步中加入NaOH溶液不足时,会使测定结果
您最近一年使用:0次
名校
4 . 大苏打 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程___________ 。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为___________ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因___________ 。
(3)下列关于苏打和小苏打的说法正确的是___________ (选填字母序号)。
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。

请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是___________ (填写化学式)
②滴入 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性___________ (填“增强”或“减弱”),试解释其原因___________ 。
③原 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为___________ 。
 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向
 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是
②滴入
 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性③原
 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为
您最近一年使用:0次
2021-02-09更新
|
1017次组卷
|
7卷引用:河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题
河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题河南省信阳市2021届高三上学期第二次教学质量检测化学试题(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题(已下线)第1讲 钠及其重要化合物
名校
解题方法
5 . 现有一份 溶液,向其中通入一定量
溶液,向其中通入一定量 ,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:
,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:
Ⅰ.配制 的标准盐酸
的标准盐酸
实验室现有密度为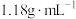 ,质量分数为36.5%的浓盐酸,若要配制
,质量分数为36.5%的浓盐酸,若要配制 标准盐酸,据此回答下列问题:
标准盐酸,据此回答下列问题:
(1)该浓盐酸的物质的量浓度为_____  ;应选用的容量瓶的规格为
;应选用的容量瓶的规格为_____ 。
(2)在配制稀盐酸溶液时,有如下操作,正确的操作顺序是_____ 。
A.用量筒量取浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
B.用蒸馏水洗涤烧杯内壁及玻璃棒仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
C.盖好瓶塞,反复上下颠倒摇匀
D.将已恢复至室温的盐酸转移注入所选用的容量瓶中
E.用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
(3)若是定容时俯视容量瓶瓶颈上的刻度线会使所配制的溶液浓度_____ (填“偏低”“偏高”“无影响”,下同);容量瓶用蒸馏水洗净后,没烘干直接使用对实验的结果_____ 。
Ⅱ、测定混合溶液成分
向混合溶液中滴入上述配制的稀盐酸,滴入盐酸体积与产生气体体积(标准状况)如图所示:
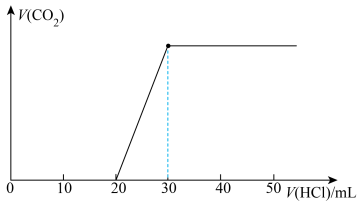
(4)混合溶液的溶质为_____ (填化学式)。
(5)原 溶液的物质的量浓度为
溶液的物质的量浓度为_____ 。
 溶液,向其中通入一定量
溶液,向其中通入一定量 ,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:
,得到一份混合溶液,为测定溶液的成分,某小组同学做了以下实验:Ⅰ.配制
 的标准盐酸
的标准盐酸实验室现有密度为
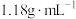 ,质量分数为36.5%的浓盐酸,若要配制
,质量分数为36.5%的浓盐酸,若要配制 标准盐酸,据此回答下列问题:
标准盐酸,据此回答下列问题:(1)该浓盐酸的物质的量浓度为
 ;应选用的容量瓶的规格为
;应选用的容量瓶的规格为(2)在配制稀盐酸溶液时,有如下操作,正确的操作顺序是
A.用量筒量取浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
B.用蒸馏水洗涤烧杯内壁及玻璃棒仪器各2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
C.盖好瓶塞,反复上下颠倒摇匀
D.将已恢复至室温的盐酸转移注入所选用的容量瓶中
E.用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
(3)若是定容时俯视容量瓶瓶颈上的刻度线会使所配制的溶液浓度
Ⅱ、测定混合溶液成分
向混合溶液中滴入上述配制的稀盐酸,滴入盐酸体积与产生气体体积(标准状况)如图所示:

(4)混合溶液的溶质为
(5)原
 溶液的物质的量浓度为
溶液的物质的量浓度为
您最近一年使用:0次
名校
6 . 如图是硫酸试剂标签上的内容。
(1)该硫酸的物质的量浓度为_____ 。
(2)实验室用该硫酸配制 的稀硫酸,则
的稀硫酸,则
①需要用量筒量取该浓硫酸的体积为_____ mL。
②为完成实验,现有仪器:烧杯、10mL量筒、胶头滴管、玻璃棒,还必需的玻璃仪器有_____ 。
(3)下列操作中,容量瓶所具备的功能有_____。
(4)在下列配制过程示意图中,有错误的是(填写序号)_____ 。
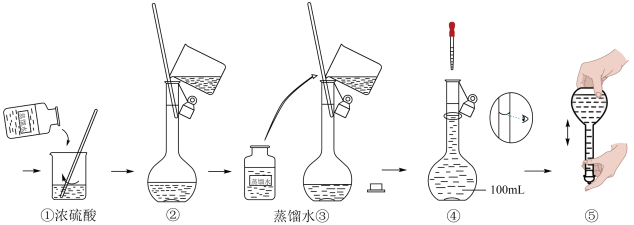
(5)在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:_____ 。
(6)下列说法正确的是_____ 。
A.洗涤烧杯和玻璃棒2-3次,并将洗涤液移入容量瓶以减少误差
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
E.容量瓶在使用前未干燥,里面有少量蒸馏水,所配溶液浓度会偏低
硫酸化学纯(CP) (500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% |
(1)该硫酸的物质的量浓度为
(2)实验室用该硫酸配制
 的稀硫酸,则
的稀硫酸,则①需要用量筒量取该浓硫酸的体积为
②为完成实验,现有仪器:烧杯、10mL量筒、胶头滴管、玻璃棒,还必需的玻璃仪器有
(3)下列操作中,容量瓶所具备的功能有_____。
| A.配制一定体积准确浓度的标准溶液 |
| B.长期贮存溶液 |
| C.用来溶解固体溶质 |
| D.常用来代替烧杯作为反应容器 |
(4)在下列配制过程示意图中,有错误的是(填写序号)

(5)在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:
(6)下列说法正确的是
A.洗涤烧杯和玻璃棒2-3次,并将洗涤液移入容量瓶以减少误差
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
E.容量瓶在使用前未干燥,里面有少量蒸馏水,所配溶液浓度会偏低
您最近一年使用:0次
名校
7 . Ⅰ.X、Y、Z三种可溶性盐,其阳离子分别是 、
、 、
、 中的某一种,阴离子分别是
中的某一种,阴离子分别是 、
、 、
、 ,中的某一种。现进行以下实验:
,中的某一种。现进行以下实验:
①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
回答下列问题:
(1)根据上述事实,推断这三种盐的化学式:X_______ ,Y_______ ,Z_______ 。
(2)写出下列反应的离子方程式。
X与氢氧化钡溶液反应:_______ 。
Y与盐酸反应:_______ 。
Ⅱ.有关物质的量的计算
(3) 和
和 一定条件下可以发生反应
一定条件下可以发生反应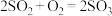 ,若有a mol
,若有a mol  与b mol
与b mol  充分反应,则反应后硫原子与氧原子的个数比为
充分反应,则反应后硫原子与氧原子的个数比为_______ (用含a、b的代数式表示)。
(4)36g CO与 的混合气体与足量
的混合气体与足量 充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与
充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与 的混合气体的总物质的量为
的混合气体的总物质的量为_______ mol,其中的CO在标准状况下的体积为_______ L。
(5)用质量分数为98%,密度为1.84g/mL的浓硫酸配制1mol/L的稀硫酸500mL,则需用量筒量取浓硫酸的体积为_______ 。
 、
、 、
、 中的某一种,阴离子分别是
中的某一种,阴离子分别是 、
、 、
、 ,中的某一种。现进行以下实验:
,中的某一种。现进行以下实验:①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
回答下列问题:
(1)根据上述事实,推断这三种盐的化学式:X
(2)写出下列反应的离子方程式。
X与氢氧化钡溶液反应:
Y与盐酸反应:
Ⅱ.有关物质的量的计算
(3)
 和
和 一定条件下可以发生反应
一定条件下可以发生反应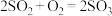 ,若有a mol
,若有a mol  与b mol
与b mol  充分反应,则反应后硫原子与氧原子的个数比为
充分反应,则反应后硫原子与氧原子的个数比为(4)36g CO与
 的混合气体与足量
的混合气体与足量 充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与
充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与 的混合气体的总物质的量为
的混合气体的总物质的量为(5)用质量分数为98%,密度为1.84g/mL的浓硫酸配制1mol/L的稀硫酸500mL,则需用量筒量取浓硫酸的体积为
您最近一年使用:0次
解题方法
8 . 月饼,又称月团、丰收饼、团圆饼等,是我国传统节日中秋节的节令食品和象征,在传统文化的传承和寄托上有着重要的作用。为了延长月饼的保鲜时间,市售月饼常会在包装袋内添加干燥剂和抗氧化剂,回答下列问题:

(1)月饼中添加的碳酸钾在水溶液中电离的电离方程式为___________ ,往碳酸钾溶液中滴加几滴无色酚酞,溶液变红,说明碳酸钾溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)工业上常使用 作食品干燥剂,
作食品干燥剂, 的俗名为
的俗名为___________ , 与水反应的化学方程式为
与水反应的化学方程式为___________ ;社会上出现多起儿童将 型干燥剂扔进水中爆炸而造成受伤的事故,引起爆炸的原因是
型干燥剂扔进水中爆炸而造成受伤的事故,引起爆炸的原因是___________ 。
(3)铁系脱氧剂的主要成分是铁粉、二氧化硅、活性炭、水、食用盐等。铁粉与氧气接触会生成氧化铁,该反应的化学方程式为___________ 。
(4)维生素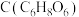 常用作食品的抗氧化剂,维生素
常用作食品的抗氧化剂,维生素 中碳元素的质量分数为
中碳元素的质量分数为___________  (保留小数点后一位),
(保留小数点后一位), 和
和 的质量比为
的质量比为___________ (用分数表示)。

(1)月饼中添加的碳酸钾在水溶液中电离的电离方程式为
(2)工业上常使用
 作食品干燥剂,
作食品干燥剂, 的俗名为
的俗名为 与水反应的化学方程式为
与水反应的化学方程式为 型干燥剂扔进水中爆炸而造成受伤的事故,引起爆炸的原因是
型干燥剂扔进水中爆炸而造成受伤的事故,引起爆炸的原因是(3)铁系脱氧剂的主要成分是铁粉、二氧化硅、活性炭、水、食用盐等。铁粉与氧气接触会生成氧化铁,该反应的化学方程式为
(4)维生素
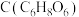 常用作食品的抗氧化剂,维生素
常用作食品的抗氧化剂,维生素 中碳元素的质量分数为
中碳元素的质量分数为 (保留小数点后一位),
(保留小数点后一位), 和
和 的质量比为
的质量比为
您最近一年使用:0次
名校
解题方法
9 . 《黄帝九鼎神丹经诀》卷九中记载着“炼石胆取精华法”,即干馏石胆(胆矾)而获得硫酸。硫酸是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼等工业中。请根据要求回答下列问题:
(1)纯净的液态硫酸______ (填“能”或“几乎不能”)导电,在硫酸不断稀释的过程中,溶液导电能力的变化情况为______ 。
(2)硫酸是强酸,具有酸的通性,如稀硫酸与氧化铁反应的化学方程式为______ ,但浓硫酸与氧化亚铁反应的化学方程式为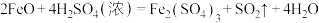 ,该反应属于
,该反应属于______ (填“氧化还原反应”或“非氧化还原反应”)。
(3)某浓硫酸的说明如图所示。该浓硫酸的物质的量浓度为______  ,从中取出100mL,则该100mL浓硫酸的物质的量浓度为
,从中取出100mL,则该100mL浓硫酸的物质的量浓度为______  ,含
,含 的物质的量为
的物质的量为______ mol。
(4)如果取5mL该浓硫酸,加水稀释至10mL,那么稀释后的硫酸的质量分数______ (填“大于”、“小于”或“等于”,下同)49%;如果取5mL该浓硫酸,加等质量的水稀释,那么稀释后的硫酸的物质的量浓度______ 原浓硫酸的物质的量浓度的一半。
(1)纯净的液态硫酸
(2)硫酸是强酸,具有酸的通性,如稀硫酸与氧化铁反应的化学方程式为
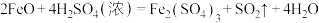 ,该反应属于
,该反应属于(3)某浓硫酸的说明如图所示。该浓硫酸的物质的量浓度为
 ,从中取出100mL,则该100mL浓硫酸的物质的量浓度为
,从中取出100mL,则该100mL浓硫酸的物质的量浓度为 ,含
,含 的物质的量为
的物质的量为| 硫酸 化学纯 CP 500mL 品名:硫酸 化学式:  相对分子质量:98 密度:1.84  质量分数:98% |
您最近一年使用:0次
解题方法
10 . 实验室需要0.5 mol·L-1硫酸溶液480 mL。回答下列问题:
(1)选取________ mL容量瓶,实验中需要质量分数为98%、密度为1.84 g·cm-3的浓硫酸________ mL,在量取时宜选用规格为________ (填序号)的量筒。
A.10 mL B.20 mL
C.50 mL D.100 mL
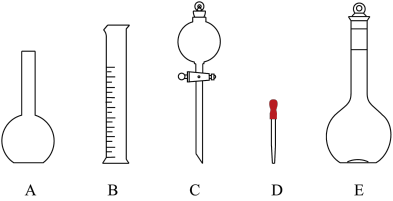
(2)如图所示的仪器中配制溶液肯定不需要的是________ (填序号),配制上述溶液还需用到的玻璃仪器是________ 、________ (填仪器名称)。
(3)在量取浓硫酸后,进行了下列操作:
①等稀释的浓硫酸的温度与室温一致后,将其沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水且边加边振荡摇匀,加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与瓶颈的刻度线相切。
③在盛有一定体积的蒸馏水的烧杯中沿杯壁注入浓硫酸,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是________ (填序号)。
(4)若实验过程中遇到下列情况,对硫酸物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未经冷却将溶液注入容量瓶中:________ ;
②定容时俯视液面:________ 。
(1)选取
A.10 mL B.20 mL
C.50 mL D.100 mL
(2)如图所示的仪器中配制溶液肯定不需要的是

(3)在量取浓硫酸后,进行了下列操作:
①等稀释的浓硫酸的温度与室温一致后,将其沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水且边加边振荡摇匀,加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与瓶颈的刻度线相切。
③在盛有一定体积的蒸馏水的烧杯中沿杯壁注入浓硫酸,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是
(4)若实验过程中遇到下列情况,对硫酸物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未经冷却将溶液注入容量瓶中:
②定容时俯视液面:
您最近一年使用:0次
2023-08-26更新
|
600次组卷
|
3卷引用:河北省衡水志华实验中学2023-2024学年高一上学期期中考试化学试题



