解题方法
1 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是“84”消毒液,可以说化学让生活更美好。图为“84”消毒液说明书。请回答下列问题:
(1)工业上常用氯气生产84消毒液,请写出反应的离子方程式___________ ,其有效成分为___________ (写化学式)。
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是___________ (用离子方程式表达)。
(3)游泳池水的消毒多用漂粉精,写出漂白精显效的化学方程式___________ 。
(4)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、“84”消毒液,主要目的___________。
 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等1:200水溶液;餐饮具、瓜果等1:100水溶液 |
(1)工业上常用氯气生产84消毒液,请写出反应的离子方程式
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是
(3)游泳池水的消毒多用漂粉精,写出漂白精显效的化学方程式
(4)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、“84”消毒液,主要目的___________。
| A.增强漂白能力和消毒作用 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白、消毒 |
您最近一年使用:0次
2 . 某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:

(1)操作a的名称是_____________ 。
(2)加入足量试剂X后,发生反应的离子方程式为_____________ 、_____________ 。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是_______ 、_________ 。
(4)硫铁矿烧渣中铁元素的质量分数为________ 。

(1)操作a的名称是
(2)加入足量试剂X后,发生反应的离子方程式为
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是
(4)硫铁矿烧渣中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 钠是一种非常活泼的金属,钠和钠的化合物在生活中有广泛的应用,请回答以下相关问题:
(1)将一小块单质Na投入 溶液,其发生反应的离子方程式为
溶液,其发生反应的离子方程式为___________ 。
(2)采用空气和单质Na为原料可以在实验室制备少量 ,空气与金属Na反应前需要依次通过的试剂为
,空气与金属Na反应前需要依次通过的试剂为___________ 、___________ 。
①饱和 溶液 ②浓硫酸 ③
溶液 ②浓硫酸 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液
(3)向酸性 溶液中加入少量
溶液中加入少量 ,可以观察到紫色褪去,溶液中产生大量气泡,其发生反应的离子方程式为
,可以观察到紫色褪去,溶液中产生大量气泡,其发生反应的离子方程式为___________ ,该现象体现了 的
的___________ (选填“氧化性”、“还原性”或“漂白性”),若有
 被还原,生成标况下气体的体积为
被还原,生成标况下气体的体积为___________ 。
(4)除去 固体中混有的少量
固体中混有的少量 固体可以采用对固体混合物充分加热的方法,其发生反应的化学方程式为
固体可以采用对固体混合物充分加热的方法,其发生反应的化学方程式为___________ ;若加热前的混合样品为5.00g,加热后的样品为4.38g,则原混合物中 的质量分数为
的质量分数为___________ 。
(5)用化学方程式表示除去 溶液中混有的少量
溶液中混有的少量 的方法
的方法___________ 。
(1)将一小块单质Na投入
 溶液,其发生反应的离子方程式为
溶液,其发生反应的离子方程式为(2)采用空气和单质Na为原料可以在实验室制备少量
 ,空气与金属Na反应前需要依次通过的试剂为
,空气与金属Na反应前需要依次通过的试剂为①饱和
 溶液 ②浓硫酸 ③
溶液 ②浓硫酸 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液(3)向酸性
 溶液中加入少量
溶液中加入少量 ,可以观察到紫色褪去,溶液中产生大量气泡,其发生反应的离子方程式为
,可以观察到紫色褪去,溶液中产生大量气泡,其发生反应的离子方程式为 的
的
 被还原,生成标况下气体的体积为
被还原,生成标况下气体的体积为(4)除去
 固体中混有的少量
固体中混有的少量 固体可以采用对固体混合物充分加热的方法,其发生反应的化学方程式为
固体可以采用对固体混合物充分加热的方法,其发生反应的化学方程式为 的质量分数为
的质量分数为(5)用化学方程式表示除去
 溶液中混有的少量
溶液中混有的少量 的方法
的方法
您最近一年使用:0次
4 . 黏土钒矿中,钒以+3价、+4价、+5价的化合物存在,还包括SiO2、Fe2O3和铝硅酸盐(Al2O3•SiO2)等。采用以下流程可由黏土钒矿制备V2O5、Fe2O3和硫酸铝铵。

已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org) MR(org)+nH+(aq)(org表示有机溶液)
MR(org)+nH+(aq)(org表示有机溶液)
ii.酸性溶液中,HR对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
iii.HR能萃取Fe3+而不能萃取Fe2+。
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有_______ 。
(2)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因:_______ 。
(3)从平衡移动原理解释加入20%H2SO4溶液的作用:_______ 。
(4)KClO3和VO2+(反应生成VO 和Cl-的离子方程式是
和Cl-的离子方程式是_______ 。
(5)测定V2O5产品的纯度
称取V2O5产品ag,先加入硫酸将V2O5转化为VO ,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO
,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO 转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是
转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是_______ (V2O5的摩尔质量为Mg/mol)。
(6)从无机层获得Fe(OH)3的离子方程式是_______ 。
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作是加热溶解、_______ 、洗涤、干燥。


已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org)
 MR(org)+nH+(aq)(org表示有机溶液)
MR(org)+nH+(aq)(org表示有机溶液)ii.酸性溶液中,HR对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
iii.HR能萃取Fe3+而不能萃取Fe2+。
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有
(2)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因:
(3)从平衡移动原理解释加入20%H2SO4溶液的作用:
(4)KClO3和VO2+(反应生成VO
 和Cl-的离子方程式是
和Cl-的离子方程式是(5)测定V2O5产品的纯度
称取V2O5产品ag,先加入硫酸将V2O5转化为VO
 ,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO
,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO 转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是
转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是(6)从无机层获得Fe(OH)3的离子方程式是
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作是加热溶解、

您最近一年使用:0次
2023-10-22更新
|
649次组卷
|
2卷引用:北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题
5 . 某烧碱样品因部分变质含 。某化学课外小组的同学利用化学方法测定该烧碱样品中
。某化学课外小组的同学利用化学方法测定该烧碱样品中 的质量分数。他们取
的质量分数。他们取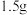 该样品完全溶解于水,然后向该溶液中逐滴加入
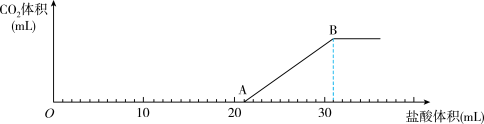
该样品完全溶解于水,然后向该溶液中逐滴加入 的盐酸,所加入盐酸的体积与产生
的盐酸,所加入盐酸的体积与产生 的体积(标准状况)关系如下图所示:
的体积(标准状况)关系如下图所示:
(1)写出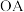 段发生反应的离子方程式:
段发生反应的离子方程式:___________ 。
(2)样品中 的质量分数
的质量分数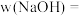
___________  。(计算结果保留2位有效数字)
。(计算结果保留2位有效数字)
 。某化学课外小组的同学利用化学方法测定该烧碱样品中
。某化学课外小组的同学利用化学方法测定该烧碱样品中 的质量分数。他们取
的质量分数。他们取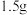 该样品完全溶解于水,然后向该溶液中逐滴加入
该样品完全溶解于水,然后向该溶液中逐滴加入 的盐酸,所加入盐酸的体积与产生
的盐酸,所加入盐酸的体积与产生 的体积(标准状况)关系如下图所示:
的体积(标准状况)关系如下图所示:
(1)写出
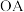 段发生反应的离子方程式:
段发生反应的离子方程式:(2)样品中
 的质量分数
的质量分数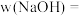
 。(计算结果保留2位有效数字)
。(计算结果保留2位有效数字)
您最近一年使用:0次
名校
解题方法
6 . 食盐是生活中的调味剂,从多角度认识食盐及主要成分 。
。
(1)从组成和结构的角度看, 由
由___________ (填“原子”“分子”或“离子”构成,属于___________ (填“酸”“䂸”或“盐”)。
(2)从水溶液或熔融状态下是否电离的角度看, 属于
属于___________ ,其电离方程式为___________ 。
(3)对于水溶液体系,从离子角度认识其性质,向 溶液中滴加硝酸银溶液,预测现象为
溶液中滴加硝酸银溶液,预测现象为___________ ,反应的离子方程式___________ 。
(4)用洁净的铂丝蘸取食盐在酒精灯火焰上灼烧,火焰的颜色是___________ 。
(5)某同学发现家里的食盐包装袋标签上,标注成分中有氯化钠、碘酸钾、柠檬酸铁铵,同学查阅资料得知,柠檬酸铁铵在水溶液中能电离出 ,从化合价的角度,你预测有
,从化合价的角度,你预测有 具有的性质是
具有的性质是___________ ,设计实验证明此性质,你选择 与
与___________ (填具体反应物或物质类别均可)发生反应。
(6) 在自然界含量丰富,工业电解饱和食盐水制得氯气、氢气和氢氧化钠,此反应的化学方程式为
在自然界含量丰富,工业电解饱和食盐水制得氯气、氢气和氢氧化钠,此反应的化学方程式为___________ ,如果氯元素完全转化为氯气,理论上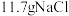 能制取的氯气在标准状况下的体积是
能制取的氯气在标准状况下的体积是___________ 。
(7)工业制得的氯气用途广泛,将氯气通入石灰乳制取漂白粉,化学反应方程式为___________ 。
(8)某居民因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液发生氯气中毒。试根据你的化学知识分析,用离子方程式解释原因___________ 。
 。
。(1)从组成和结构的角度看,
 由
由(2)从水溶液或熔融状态下是否电离的角度看,
 属于
属于(3)对于水溶液体系,从离子角度认识其性质,向
 溶液中滴加硝酸银溶液,预测现象为
溶液中滴加硝酸银溶液,预测现象为(4)用洁净的铂丝蘸取食盐在酒精灯火焰上灼烧,火焰的颜色是
(5)某同学发现家里的食盐包装袋标签上,标注成分中有氯化钠、碘酸钾、柠檬酸铁铵,同学查阅资料得知,柠檬酸铁铵在水溶液中能电离出
 ,从化合价的角度,你预测有
,从化合价的角度,你预测有 具有的性质是
具有的性质是 与
与(6)
 在自然界含量丰富,工业电解饱和食盐水制得氯气、氢气和氢氧化钠,此反应的化学方程式为
在自然界含量丰富,工业电解饱和食盐水制得氯气、氢气和氢氧化钠,此反应的化学方程式为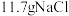 能制取的氯气在标准状况下的体积是
能制取的氯气在标准状况下的体积是(7)工业制得的氯气用途广泛,将氯气通入石灰乳制取漂白粉,化学反应方程式为
(8)某居民因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液发生氯气中毒。试根据你的化学知识分析,用离子方程式解释原因
您最近一年使用:0次
名校
解题方法
7 . 含氯消毒剂在生产生活中被广泛用于杀菌、消毒和漂白。
(1)氯水具有漂白性,其中起漂白作用的物质是
(2)氯水需要避光保存,原因是
(3)通常将Cl2与NaOH或
 反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为
反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为(4)漂白粉[成分为
 、
、 和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:
和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:a.不宜用金属容器盛装
b.勿与酸性物质混用
c.水体中铵盐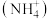 含量高,使用时产生NH3
含量高,使用时产生NH3
d.水体中亚硝酸盐(NO2)含量高,会降低其消毒效果
①注意事项a说明漂白粉具有
②为了验证注意事项b,向漂白粉中滴加稀硫酸,产生黄绿色气体,被还原的微粒是
③注意事项c中NH3产生的原因是
④从物质性质的角度解释注意事项d中漂白粉消毒效果降低的原因 浓度较高的鱼塘使用漂白粉,会使水中
浓度较高的鱼塘使用漂白粉,会使水中 含量升高,池水富营养化。)
含量升高,池水富营养化。)
您最近一年使用:0次
名校
解题方法
8 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是一种___________ 色的气体;氯气与水反应的化学方程式为___________ ;氯水中滴加少量紫色石蕊试液的现象是___________ 。
(2)氯气和石灰乳反应可以制备漂白粉,漂白粉的有效成分是___________ ;次氯酸盐与空气中的二氧化碳和水蒸气反应可生成次氯酸,从而发挥漂白和消毒作用,用化学方程式表示漂白粉的漂白和消毒原理___________ 。
(3)二氧化氯(ClO2)是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为___________ ;ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl-除去。下列试剂中,可将ClO
),需将其转化为Cl-除去。下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是___________ (填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为___________ ;工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产100kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
(1)氯气是一种
(2)氯气和石灰乳反应可以制备漂白粉,漂白粉的有效成分是
(3)二氧化氯(ClO2)是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为
 ),需将其转化为Cl-除去。下列试剂中,可将ClO
),需将其转化为Cl-除去。下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是a.FeSO4 b.O3 c.KMnO4 d.SO2
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
您最近一年使用:0次
名校
解题方法
9 . 为测定某含有杂质 的
的 样品的纯度,2个小组分别设计如下方案。首先准确称量样品
样品的纯度,2个小组分别设计如下方案。首先准确称量样品 ,然后,按照以下方案进行实验,请你完成相关内容:
,然后,按照以下方案进行实验,请你完成相关内容:
[方案一]:将样品与水充分反应,使产生的 通过灼热的铜粉,测得反应后生成氧化铜的质量为
通过灼热的铜粉,测得反应后生成氧化铜的质量为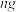 ,通过计算求出试样中
,通过计算求出试样中 的含量。
的含量。
(1) 跟水反应的离子方程式是
跟水反应的离子方程式是_______ 。
[方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中 的含量。
的含量。

(2)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是_______ (填写仪器编号)
(3) 跟
跟 的化学反应方程式为
的化学反应方程式为_______
(4)装置①和⑤的作用分别是_______ 和_______ 。
 的
的 样品的纯度,2个小组分别设计如下方案。首先准确称量样品
样品的纯度,2个小组分别设计如下方案。首先准确称量样品 ,然后,按照以下方案进行实验,请你完成相关内容:
,然后,按照以下方案进行实验,请你完成相关内容:[方案一]:将样品与水充分反应,使产生的
 通过灼热的铜粉,测得反应后生成氧化铜的质量为
通过灼热的铜粉,测得反应后生成氧化铜的质量为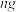 ,通过计算求出试样中
,通过计算求出试样中 的含量。
的含量。(1)
 跟水反应的离子方程式是
跟水反应的离子方程式是[方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中
 的含量。
的含量。
(2)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是
(3)
 跟
跟 的化学反应方程式为
的化学反应方程式为(4)装置①和⑤的作用分别是
您最近一年使用:0次
名校
10 . 84 消毒液是一种常见的含氯消毒剂。下图为某品牌 84 消毒液的说明书中部分内容。

(1)84 消毒液中含有的物质除了 H2O 还有______________ (用化学式表示)
(2)常温,将氯气通入 NaOH 溶液中可制得“84”消毒液。写出离子方程式:______________ 。
(3)某同学研究 84 消毒液的漂白性,实验如下。
资料:①84 消毒液中含氯微粒主要有 ClO- 、Cl- 、HClO;
②相同浓度时,HClO 的氧化性强于 ClO-;
③ORP 是反映水溶液中所有物质表现出来的氧化—还原性, ORP 值越大,氧化性越强。
Ⅰ.将 2 ml 84 消毒液中加 2 ml 水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将 2 ml 84 消毒液中加入 2 ml 白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得 84 消毒液在不同温度时 ORP 随时间的变化曲线如下图。
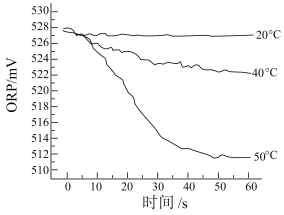
① 已知白醋(主要成分 CH3COOH)显酸性,不具有漂白性。结合化学用语和必要的文字说明,解释实验Ⅱ中纸片褪色比实验Ⅰ更快的原因是______________ 。
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是______________ 。
③由实验Ⅲ可得出的结论是______________ 。ORP 值不同的原因可能是 ______________ 。
(4)针对不同物品的消毒,84 消毒液需要稀释到不同的浓度来使用。取次氯酸钠含量为14.9 g/L 的 84 消毒液 1 mL ,加水稀释至 100 mL,则稀释后的溶液中次氯酸钠的物质的量浓度为______________ mol/L。
| 产品特点 本品是以次氯酸钠为有效成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 1. 本品易使有色衣物脱色,禁止用于丝、毛、麻织物的消毒。 2. 不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3. 置于避光、阴凉处保存。 4. 需稀释后使用,勿口服。 |

(1)84 消毒液中含有的物质除了 H2O 还有
(2)常温,将氯气通入 NaOH 溶液中可制得“84”消毒液。写出离子方程式:
(3)某同学研究 84 消毒液的漂白性,实验如下。
资料:①84 消毒液中含氯微粒主要有 ClO- 、Cl- 、HClO;
②相同浓度时,HClO 的氧化性强于 ClO-;
③ORP 是反映水溶液中所有物质表现出来的氧化—还原性, ORP 值越大,氧化性越强。
Ⅰ.将 2 ml 84 消毒液中加 2 ml 水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将 2 ml 84 消毒液中加入 2 ml 白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得 84 消毒液在不同温度时 ORP 随时间的变化曲线如下图。

① 已知白醋(主要成分 CH3COOH)显酸性,不具有漂白性。结合化学用语和必要的文字说明,解释实验Ⅱ中纸片褪色比实验Ⅰ更快的原因是
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
(4)针对不同物品的消毒,84 消毒液需要稀释到不同的浓度来使用。取次氯酸钠含量为14.9 g/L 的 84 消毒液 1 mL ,加水稀释至 100 mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次



