解题方法
1 . 某种胃药的有效成分为碳酸钙,为测定其含量,现将2.0g该药片溶于50mL稀盐酸中充分反应(药片中的其他成分不与盐酸反应),产生标准状况下 气体。
气体。
(1)若盐酸恰好完全反应,则其物质的量浓度为___________ 。
(2)药片中碳酸钙的质量分数为___________ 。
 气体。
气体。(1)若盐酸恰好完全反应,则其物质的量浓度为
(2)药片中碳酸钙的质量分数为
您最近一年使用:0次
名校
解题方法
2 . NaCl是一种化工原料,可以制备多种物质,如图所示。
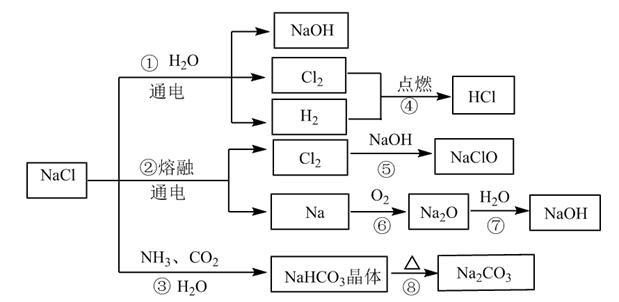
请回答下列问题:
(1)图所列物质中属于电解质的有___________ 种,转化反应中属于氧化还原反应的有___________ (填图中序号)
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是___________ 。
(3)反应④的现象是___________ ;反应⑤的化学方程式为___________ 。
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=___________ mol/L(结果保留两位小数);“84消毒液”不能与“洁厕灵(主要成分是HCl)”混合使用,否则会产生黄绿色的有毒气体引起安全事故,其反应的离子方程式是___________ 。

请回答下列问题:
(1)图所列物质中属于电解质的有
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是
(3)反应④的现象是
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=
您最近一年使用:0次
2021-11-13更新
|
356次组卷
|
2卷引用:云南省教育联盟2022-2023学年高一上学期期末学业水平测试化学试题
解题方法
3 . 为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将ag铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将a/10g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:__________________________
 KMnO4+
KMnO4+ FeSO4+
FeSO4+ H2SO4===
H2SO4=== Fe2(SO4)3+
Fe2(SO4)3+ MnSO4+
MnSO4+ K2SO4+
K2SO4+ H2O
H2O
(2)在滴定实验中不能选择________ 式滴定管,理由是______________ ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________ 和________ ;
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一________ (填“准确”、“不准确”或“不一定准确”),理由是____________ ;
②方案二________ (填“准确”、“不准确”或“不一定准确”),理由是_____________ 。
方案一:将ag铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将a/10g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
 KMnO4+
KMnO4+ FeSO4+
FeSO4+ H2SO4===
H2SO4=== Fe2(SO4)3+
Fe2(SO4)3+ MnSO4+
MnSO4+ K2SO4+
K2SO4+ H2O
H2O(2)在滴定实验中不能选择
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一
②方案二
您最近一年使用:0次
4 . 从初中化学的角度来看中国铁路的发展。
(1)高铁列车的车体建设需要消耗大量的铝合金。铝具有很强的抗腐蚀性,其原因是_____ 。
(2)修建铁路需要大量钢铁。用一氧化碳和赤铁矿炼铁的化学方程式为_____ ;雨后的铁轨表面容易产生锈迹,原因_____ 。
(3)高铁列车车厢是密闭的空间,提供清洁空气、保持车厢卫生非常重要。某品牌的空气净化剂含有过氧化钠(Na2O2),它可以使车厢里的二氧化碳转化为氧气,同时生成碳酸钠,其反应的化学反应方程式为_____ 。
(4)将铁片和银片分别装入两支试管中,并同时加入等体积等质量分数的Cu(NO3)2溶液,可观察到的现象是_____ ,由此可知铁、银、铜三种金属的活动性由弱到强的是_____ 。
(5)下列食物是高铁列车上提供的食物,其中主要富含蛋白质的是_____。
(1)高铁列车的车体建设需要消耗大量的铝合金。铝具有很强的抗腐蚀性,其原因是
(2)修建铁路需要大量钢铁。用一氧化碳和赤铁矿炼铁的化学方程式为
(3)高铁列车车厢是密闭的空间,提供清洁空气、保持车厢卫生非常重要。某品牌的空气净化剂含有过氧化钠(Na2O2),它可以使车厢里的二氧化碳转化为氧气,同时生成碳酸钠,其反应的化学反应方程式为
(4)将铁片和银片分别装入两支试管中,并同时加入等体积等质量分数的Cu(NO3)2溶液,可观察到的现象是
(5)下列食物是高铁列车上提供的食物,其中主要富含蛋白质的是_____。
| A.牛肉 | B.馒头 | C.苹果 | D.米饭 |
您最近一年使用:0次
5 . 铁是人类较早使用的金属之一,根据铁及其化合物之间的相互转化,回答下列问题:
(1)Fe2+易被人体吸收,医生建议在服用补铁剂时,同时服用维生素C.维生素C的作用是______ 。
(2)印刷电路板的制作原理是用足量的FeCl3溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的离子方程式:______ 。
(3)某废料铁泥的主要成分为Fe2O3、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取Fe2O3,设计实验流程如下:

①分离溶液A和沉淀C的实验操作为______ 。
②能检验溶液A中含有Fe2+的试剂是______ (填字母)。
A.铁粉 B.酸性KMnO4溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为______ 。
④若最终获得ngFe2O3,则废料铁泥中铁元素的质量分数为______ 。
(1)Fe2+易被人体吸收,医生建议在服用补铁剂时,同时服用维生素C.维生素C的作用是
(2)印刷电路板的制作原理是用足量的FeCl3溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的离子方程式:
(3)某废料铁泥的主要成分为Fe2O3、FeO、Fe和杂质(杂质不与硫酸反应)。现取wg废料铁泥提取Fe2O3,设计实验流程如下:

①分离溶液A和沉淀C的实验操作为
②能检验溶液A中含有Fe2+的试剂是
A.铁粉 B.酸性KMnO4溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为
④若最终获得ngFe2O3,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
解题方法
6 . 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分,试根据标签上的相关数据回答下列问题:
实验室欲用上述浓硫酸和蒸馏水配制 的稀硫酸:
的稀硫酸:
(1)完成本实验所必需的仪器有:烧杯、玻璃棒、___________ 、___________ 、量筒等。
(2)配制溶液前必须进行的操作是___________ 。
(3)计算该浓硫酸中 的物质的量浓度为
的物质的量浓度为___________  。
。
(4)用量筒量取该浓硫酸时应选用的量筒规格为___________(填序号)。
(5)稀释时的操作为___________ 。
(6)下列操作会使所配溶液浓度偏低的是___________(填序号)。
硫酸化学纯 品名:硫酸 化学式: 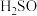 相对分子质量:98 密度:  质量分数:98% |
 的稀硫酸:
的稀硫酸:(1)完成本实验所必需的仪器有:烧杯、玻璃棒、
(2)配制溶液前必须进行的操作是
(3)计算该浓硫酸中
 的物质的量浓度为
的物质的量浓度为 。
。(4)用量筒量取该浓硫酸时应选用的量筒规格为___________(填序号)。
A. | B. | C. | D. |
(6)下列操作会使所配溶液浓度偏低的是___________(填序号)。
| A.定容时仰视读数 |
| B.量取浓硫酸的量筒未洗涤 |
| C.容量瓶用蒸馏水洗净后仍残留有蒸馏水 |
| D.定容摇匀后,发现液面低于刻度线,再加水至刻度线 |
您最近一年使用:0次
7 . 用质量分数为36.5%的浓盐酸(密度为1.2 )配制成1
)配制成1 的稀盐酸。现实验室需这种1
的稀盐酸。现实验室需这种1 的稀盐酸80mL,试回答下列问题:
的稀盐酸80mL,试回答下列问题:
(1)计算浓盐酸的物质的量浓度为______ 。
(2)配制稀盐酸时,应选用______ mL的容量瓶。
(3)经计算需要______ mL浓盐酸,在量取时宜选用______ (填序号)的量筒。
A.5mL B.10mL C.25mL D.50mL
(4)配制时正确的操作顺序是______ (用字母表示)。
a.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
b.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
c.将已恢复至室温的盐酸沿玻璃棒注入容量瓶中
d.将容量瓶盖紧,颠倒摇匀
e.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
f.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(5)从溶液改变角度分析产生的误差______(用“偏大”“偏小”或“无影响”填空)。
①配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容:______ 。
②定容摇匀后,发现液面下降,继续加水至刻度线:______ 。
③定容时仰视刻度线:______ 。
(6)现将200mL 0.2mol/L盐酸与300mL 0.3mol/L 溶液混合,溶液体积变化忽略不计,所得溶液中
溶液混合,溶液体积变化忽略不计,所得溶液中 的物质的量浓度是
的物质的量浓度是______ mol/L。
 )配制成1
)配制成1 的稀盐酸。现实验室需这种1
的稀盐酸。现实验室需这种1 的稀盐酸80mL,试回答下列问题:
的稀盐酸80mL,试回答下列问题:(1)计算浓盐酸的物质的量浓度为
(2)配制稀盐酸时,应选用
(3)经计算需要
A.5mL B.10mL C.25mL D.50mL
(4)配制时正确的操作顺序是
a.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
b.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
c.将已恢复至室温的盐酸沿玻璃棒注入容量瓶中
d.将容量瓶盖紧,颠倒摇匀
e.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
f.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(5)从溶液改变角度分析产生的误差______(用“偏大”“偏小”或“无影响”填空)。
①配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容:
②定容摇匀后,发现液面下降,继续加水至刻度线:
③定容时仰视刻度线:
(6)现将200mL 0.2mol/L盐酸与300mL 0.3mol/L
 溶液混合,溶液体积变化忽略不计,所得溶液中
溶液混合,溶液体积变化忽略不计,所得溶液中 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
名校
解题方法
8 . 根据要求进行计算:
(1)amolHClO4中含b个氧原子,则阿伏加德罗常数NA=_______ mol-1(用含a、b的代数式表示)。
(2)某含氯化合物X在标准状况下为气体,7.3gX在标准状况下的体积为4.48L,则X的摩尔质量是_______ 。
(3)1774年瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。
MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。
①生成的氯气在标准状况下的体积是_______ 。
②稀释后溶液中MnCl2的物质的量浓度是_______ 。
(1)amolHClO4中含b个氧原子,则阿伏加德罗常数NA=
(2)某含氯化合物X在标准状况下为气体,7.3gX在标准状况下的体积为4.48L,则X的摩尔质量是
(3)1774年瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合制氯气:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。
MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。①生成的氯气在标准状况下的体积是
②稀释后溶液中MnCl2的物质的量浓度是
您最近一年使用:0次
名校
解题方法
9 . 镁铝合金具有很好的强度、刚性和尺寸稳定性,常用来制作又轻又薄的笔记本电脑、手机等的外壳。把10.2 g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算:
(1)该合金中铝的质量分数是_______ 。
(2)该合金中镁与铝的物质的量之比是_______ 。
(3)该合金溶于足量的盐酸中,标准状况下产生氢气的体积是_______ 。
(1)该合金中铝的质量分数是
(2)该合金中镁与铝的物质的量之比是
(3)该合金溶于足量的盐酸中,标准状况下产生氢气的体积是
您最近一年使用:0次
2022-12-13更新
|
161次组卷
|
2卷引用:云南省玉溪市江川区第二中学2021-2022学年高一下学期开学考试化学试题
解题方法
10 . 以焙烧黄铁矿产生的红渣(主要成分为 ,杂质为石英)为原料可制备铵铁蓝
,杂质为石英)为原料可制备铵铁蓝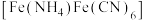 颜料,工艺流程如图。
颜料,工艺流程如图。
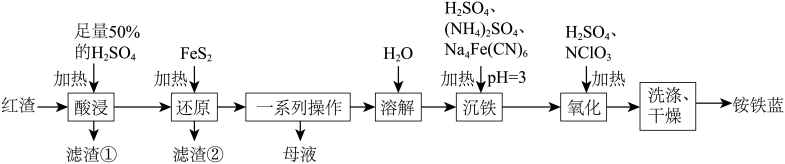
回答下列问题:
(1) 的俗称为
的俗称为_______ ,“酸浸”前将红渣研细的目的是_______ 。
(2)“酸浸”时发生反应的化学方程式为_______ 。
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为_______ 。
(4))“一系列操作”包括蒸发浓缩、冷却结晶、过滤洗涤,蒸发浓缩过程中需要在溶液中加入一定量的铁粉,其目的是_______ 。
(5)如何检验“沉铁”后的溶液中是否含有 ?
?_______ 。
(6)简述洗涤铵铁蓝的操作:_______ 。
(7)若取10 kg含 的质量分数为96%的红渣经过上述流程(铁元素在整个流程中的损失率约为5%),则可制得铵铁蓝的质量为16.302 kg。该计算结果
的质量分数为96%的红渣经过上述流程(铁元素在整个流程中的损失率约为5%),则可制得铵铁蓝的质量为16.302 kg。该计算结果_______ (填“正确”或“不正确”)。
 ,杂质为石英)为原料可制备铵铁蓝
,杂质为石英)为原料可制备铵铁蓝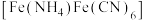 颜料,工艺流程如图。
颜料,工艺流程如图。
回答下列问题:
(1)
 的俗称为
的俗称为(2)“酸浸”时发生反应的化学方程式为
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为
(4))“一系列操作”包括蒸发浓缩、冷却结晶、过滤洗涤,蒸发浓缩过程中需要在溶液中加入一定量的铁粉,其目的是
(5)如何检验“沉铁”后的溶液中是否含有
 ?
?(6)简述洗涤铵铁蓝的操作:
(7)若取10 kg含
 的质量分数为96%的红渣经过上述流程(铁元素在整个流程中的损失率约为5%),则可制得铵铁蓝的质量为16.302 kg。该计算结果
的质量分数为96%的红渣经过上述流程(铁元素在整个流程中的损失率约为5%),则可制得铵铁蓝的质量为16.302 kg。该计算结果
您最近一年使用:0次



