名校
1 . 大苏打 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程___________ 。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为___________ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因___________ 。
(3)下列关于苏打和小苏打的说法正确的是___________ (选填字母序号)。
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。

请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是___________ (填写化学式)
②滴入 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性___________ (填“增强”或“减弱”),试解释其原因___________ 。
③原 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为___________ 。
 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向
 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是
②滴入
 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性③原
 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为
您最近一年使用:0次
2021-02-09更新
|
1017次组卷
|
7卷引用:新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题
新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题河南省信阳市2021届高三上学期第二次教学质量检测化学试题(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第1讲 钠及其重要化合物
2 . 漂白粉能杀死禽流感病毒等。其稳定性比氯水高。
(1)工业上制取漂白粉的化学方程式为___________ ,漂白粉的有效成分是________________ 。
(2)漂白粉暴露在空气中易失效的主要原因是________________________________ 。(用化学方程式表示)
(3)有效氯是漂白粉中有效成分Ca(ClO)2 含量大小的标志。
已知:①Ca(ClO)2+4HCl==CaCl2+2Cl2+2H2O;
② .若某漂粉精的有效氯为65%,该漂粉精中Ca(ClO)2的质量分数为
.若某漂粉精的有效氯为65%,该漂粉精中Ca(ClO)2的质量分数为________ 。
(1)工业上制取漂白粉的化学方程式为
(2)漂白粉暴露在空气中易失效的主要原因是
(3)有效氯是漂白粉中有效成分Ca(ClO)2 含量大小的标志。
已知:①Ca(ClO)2+4HCl==CaCl2+2Cl2+2H2O;
②
 .若某漂粉精的有效氯为65%,该漂粉精中Ca(ClO)2的质量分数为
.若某漂粉精的有效氯为65%,该漂粉精中Ca(ClO)2的质量分数为
您最近一年使用:0次
2017-11-24更新
|
249次组卷
|
2卷引用:新疆和田地区皮山县2022-2023学年高一上学期11月期中考试化学试题
名校
3 . 根据已经学过的化学知识,回答下列问题。
Ⅰ.金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现___________ 性;___________ (填“能”或“不能”)用氢氧化钠溶液代替。
(2)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式:___________ 。
Ⅱ.物质的量是学习化学的基础。
(3)在标准状况下8.96 L CO2的分子数为___________ 。
(4)19 g某二价金属的氯化物ACl2中含有0.4 mol Cl-,金属A的相对原子质量是___________ 。
(5)质量分数为24%、密度为1.18g/m3的NaClO溶液的物质的量浓度约为___________ mol·L-1(计算结果保留一位小数)。在用NaClO固体配制100mL  溶液过程中,下列操作中能使所配溶液的浓度偏高的有
溶液过程中,下列操作中能使所配溶液的浓度偏高的有___________ (填序号)。
①用托盘天平称量时物品和砝码放反(托盘天平的最小砝码为1g)
②烧杯中固体溶解后未冷却直接转移定容
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
(6)根据反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,可知当有2.5 mol FeS2参加反应时,被氧化的硫元素的物质的量为___________ mol。
Ⅰ.金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现
(2)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式:
Ⅱ.物质的量是学习化学的基础。
(3)在标准状况下8.96 L CO2的分子数为
(4)19 g某二价金属的氯化物ACl2中含有0.4 mol Cl-,金属A的相对原子质量是
(5)质量分数为24%、密度为1.18g/m3的NaClO溶液的物质的量浓度约为
 溶液过程中,下列操作中能使所配溶液的浓度偏高的有
溶液过程中,下列操作中能使所配溶液的浓度偏高的有①用托盘天平称量时物品和砝码放反(托盘天平的最小砝码为1g)
②烧杯中固体溶解后未冷却直接转移定容
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
(6)根据反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,可知当有2.5 mol FeS2参加反应时,被氧化的硫元素的物质的量为
您最近一年使用:0次
名校
4 . 某化学实验室需要0.6 硫酸溶液480
硫酸溶液480 。现用质量分数为98%、密度为1.84
。现用质量分数为98%、密度为1.84 的浓硫酸来配制,根据溶液的配制情况回答下列问题:
的浓硫酸来配制,根据溶液的配制情况回答下列问题:

(1)计算所需该浓硫酸的物质的量浓度为___________ 。
(2)选用容量瓶的规格为___________ mL。需该浓硫酸体积为___________  (保留1位小数)。
(保留1位小数)。
(3)配置过程中需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是___________ 。
(4)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为:②→①→③→___________ →___________→___________→___________→④(填序号)。
(5)在配制过程中,下列操作能引起误差偏高的有___________ (填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③转移前,容量瓶中含有少量蒸馏水
④定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑤定容时,俯视刻度线
 硫酸溶液480
硫酸溶液480 。现用质量分数为98%、密度为1.84
。现用质量分数为98%、密度为1.84 的浓硫酸来配制,根据溶液的配制情况回答下列问题:
的浓硫酸来配制,根据溶液的配制情况回答下列问题:
(1)计算所需该浓硫酸的物质的量浓度为
(2)选用容量瓶的规格为
 (保留1位小数)。
(保留1位小数)。(3)配置过程中需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是
(4)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为:②→①→③→
(5)在配制过程中,下列操作能引起误差偏高的有
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③转移前,容量瓶中含有少量蒸馏水
④定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑤定容时,俯视刻度线
您最近一年使用:0次
2022-08-25更新
|
139次组卷
|
2卷引用:新疆第二师八一中学2022-2023学年高三上学期第一次月考化学试题
5 . I.回答下列问题:
(1)人体缺乏某种微量元素将导致血液输送氧气能力下降,人体就无法获得充足的氧气,生理机能就会下降,该微量元素是_____ (填字母)。
a.碘 b.锌 c.铁
(2)抗生素是抑制某些微生物生长或杀灭某些微生物的一类物质,下列属于抗生素的是_____ (填字母)。
a.阿莫西林 b.胃舒平 c.阿司匹林
II.表中是我国部分城市空气质量周报,回答下列问题:(TSP—空气中的飘尘)
(3)最容易出现酸雨的城市是____ 。
(4)NaOH溶液可吸收废气中的氮氧化物,反应方程式:2NO2+2NaOH=NaNO2+NaNO3+H2O。反应时消耗了10L0.1mol•L-1NaOH溶液,则反应中转移电子的数目为:____ 。
III.湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种污染物的最高允许排放浓度如表:
(5)现有某工厂每日排放的污水中汞的质量分数为(1×10-6)%,镉的质量分数为(2×10-5)%,铅的质量分数为(5×10-5)%(设该污水的密度为1g/cm3)。根据计算该厂三项污染物中____ 超标。
(1)人体缺乏某种微量元素将导致血液输送氧气能力下降,人体就无法获得充足的氧气,生理机能就会下降,该微量元素是
a.碘 b.锌 c.铁
(2)抗生素是抑制某些微生物生长或杀灭某些微生物的一类物质,下列属于抗生素的是
a.阿莫西林 b.胃舒平 c.阿司匹林
II.表中是我国部分城市空气质量周报,回答下列问题:(TSP—空气中的飘尘)
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 天津 | 82 | TSP | II | 武汉 | 83 | NOx | II |
| 哈尔滨 | 96 | TSP | II | 重庆 | 98 | SOx | II |
(4)NaOH溶液可吸收废气中的氮氧化物,反应方程式:2NO2+2NaOH=NaNO2+NaNO3+H2O。反应时消耗了10L0.1mol•L-1NaOH溶液,则反应中转移电子的数目为:
III.湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种污染物的最高允许排放浓度如表:
| 污染物 | 汞 | 镉 | 铅 |
| 主要存在形式 | Hg2+ | Cd2+ | Pb2+ |
| 最高允许排放浓度/(mg•dm-3) | 0.05 | 0.1 | 1.0 |
您最近一年使用:0次
名校
6 . 用化学用语填空:空气中含量最多的气体是___________ ;地壳中含量最多的金属元素与人体中含量最多的非金属元素形成化合物的化学式为___________ 。保持水化学性质的最小粒子是___________ 。
您最近一年使用:0次
名校
解题方法
7 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、_________ 、_________ 。
②下列关于“容量瓶及其使用”的叙述中正确的是_________ (填序号)。
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是_________ (填序号)。
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和__________________ 。该反应中还原剂与氧化剂的物质的量之比为_________ 。
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有_____ (填氧化性、还原性)。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、
②下列关于“容量瓶及其使用”的叙述中正确的是
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有
您最近一年使用:0次
2023-01-06更新
|
208次组卷
|
2卷引用:新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题
名校
8 . 元素周期表是学习和研究化学的重要工具,下面是元素周期表的部分内容,请根据下表回答问题:
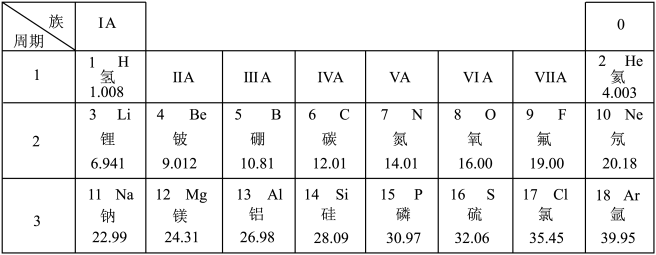
(1)发现了元素周期律并编制出元素周期表的化学家是___________(填字母)。
(2)氟元素是人体必需微量元素之一,能防治龋齿。氟元素的相对原子质量为___________ 。
(3)已知某微粒的结构示意图为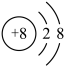 ,请写出该微粒的符号
,请写出该微粒的符号___________ 。
(4)地壳中含量最多的金属元素和最多的非金属元素组成的化合物的化学式为___________ 。
(5)表中Ne和Ar的化学性质相似的原因是___________ 。

(1)发现了元素周期律并编制出元素周期表的化学家是___________(填字母)。
| A.门捷列夫 | B.拉瓦锡 | C.道尔顿 | D.阿伏加德罗 |
(3)已知某微粒的结构示意图为
 ,请写出该微粒的符号
,请写出该微粒的符号(4)地壳中含量最多的金属元素和最多的非金属元素组成的化合物的化学式为
(5)表中Ne和Ar的化学性质相似的原因是
您最近一年使用:0次
名校
解题方法
9 . 据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为___ mol⋅L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___ 。
A.溶液中Cl-的物质的量
B.溶液的物质的量浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制450mL,物质的量浓度为0.400mol⋅L-1的稀盐酸,需用到的玻璃仪器有:烧杯,玻璃棒,胶头滴管,___ ,___ 。
(4)在容量瓶的使用方法中,下列操作不正确的是___ (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用胶头滴管加蒸馏水到标线
D.摇匀后,容量瓶内溶液的液面下降,无需再加水
(5)现欲配制(3)中的盐酸溶液,回答下列问题:
①该学生需要量取___ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”,“偏小”、“无影响”)。
I.定容时仰视刻度线,结果___ ;
II.容量瓶中有少量水即用来配制溶液,结果___ ;
Ⅲ.用量筒量取浓盐酸时,俯视读数,结果___ 。
| 盐酸 | |
| 分子式 | HCl |
| 相对分子质量 | 36.5 |
| 密度 | 1.19g/mL |
| HCl的质量分数 | 36.5% |
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
A.溶液中Cl-的物质的量
B.溶液的物质的量浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制450mL,物质的量浓度为0.400mol⋅L-1的稀盐酸,需用到的玻璃仪器有:烧杯,玻璃棒,胶头滴管,
(4)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用胶头滴管加蒸馏水到标线
D.摇匀后,容量瓶内溶液的液面下降,无需再加水
(5)现欲配制(3)中的盐酸溶液,回答下列问题:
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”,“偏小”、“无影响”)。
I.定容时仰视刻度线,结果
II.容量瓶中有少量水即用来配制溶液,结果
Ⅲ.用量筒量取浓盐酸时,俯视读数,结果
您最近一年使用:0次
名校
10 . (1)当光束通过下列物质时,会出现丁达尔效应的是_______ 。
①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
(2)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有_______ (填“氧化性”或“还原性”)。
(3)下列各组混合物的分离或提纯选用哪种方法最合适?(把选用的标号填入括号内)
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏 H.升华
①把溴水中的溴提取出来_______
②分离柴油和水的混合物_______
③分离四氯化碳(沸点为 76.75℃)和甲苯(沸点为 110.6℃)的混合物_______
(4)现有以下物质:①Ba(OH)2晶体,②盐酸,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
Ⅰ、以上物质中属于电解质的是_______ 。
Ⅱ、以上物质中属于非电解质的是_______ 。
Ⅲ、请写出①在水溶液中的电离方程式_______ 。
(5)某学校实验室有一瓶浓硫酸试剂,标签上标有密度1.84g·cm-3,质量分数98%,现用该浓硫酸配制480 mL 1mol·L﹣1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
a.配制稀硫酸时,除了上述仪器,还缺少的仪器有_______ (写仪器名称)。
b.经计算,配制480mL 1mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为_______ mL。
①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
(2)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
(3)下列各组混合物的分离或提纯选用哪种方法最合适?(把选用的标号填入括号内)
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏 H.升华
①把溴水中的溴提取出来
②分离柴油和水的混合物
③分离四氯化碳(沸点为 76.75℃)和甲苯(沸点为 110.6℃)的混合物
(4)现有以下物质:①Ba(OH)2晶体,②盐酸,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
Ⅰ、以上物质中属于电解质的是
Ⅱ、以上物质中属于非电解质的是
Ⅲ、请写出①在水溶液中的电离方程式
(5)某学校实验室有一瓶浓硫酸试剂,标签上标有密度1.84g·cm-3,质量分数98%,现用该浓硫酸配制480 mL 1mol·L﹣1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
a.配制稀硫酸时,除了上述仪器,还缺少的仪器有
b.经计算,配制480mL 1mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为
您最近一年使用:0次



